
| A. | 14C原子结构示意图: | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | CO2的电子式: | D. | CH4分子的球棍模型: |
分析 A.碳原子的核电荷数=核外电子总数=6,最外层为4个电子;
B.次氯酸的中心原子为O原子,不存在氢氯键;
C.二氧化碳为共价化合物,分子中含有两个碳氧双键;
D. 为甲烷的比例模型,不是球棍模型.
为甲烷的比例模型,不是球棍模型.
解答 解:A.碳原子的核电荷数、核外电子总数都是6,14C原子结构示意图为: ,故A正确;
,故A正确;
B.次氯酸分子中含有1个氧氢键和1个氧氯键,次氯酸正确的结构式为:H-O-Cl,故B错误;
C.二氧化碳分子中含有两个碳氧双键,属于共价化合物,二氧化碳正确的电子式为: ,故C错误;
,故C错误;
D.甲烷分子中含有4个碳氢键,为正四面体结构, 是甲烷的比例模型,甲烷的球棍模型为:
是甲烷的比例模型,甲烷的球棍模型为: ,故D错误;
,故D错误;
故选A.
点评 本题考查了常见化学用语的书写方法判断,题目难度中等,注意掌握比例模型与球棍模型、电子式、原子结构示意图、结构式等化学用语的书写原则,明确球棍模型与比例模型、原子结构与离子结构示意图的区别.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 HCO3-+OH-,与油污发生反应,达到去污目的.
HCO3-+OH-,与油污发生反应,达到去污目的.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl在饱和NaCl溶液中的KSP比在纯水中的KSP小 | |
| B. | KSP(AgCl)>KSP(Ag2CrO4),可说明Ag2CrO4比AgCl难溶于水 | |
| C. | 将0.00lmol•L-1AgNO3溶液滴入0.001 mol•L-1KC1和0.00lmol•L-1K2CrO4混合溶液中,先产生Ag2CrO4沉淀 | |
| D. | 同AgCl的悬浊液中滴加浓氨水后沉淀溶解,是因为生成了银氨离子而使AgCl的溶解平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
 (填该物质的电子式)③加成反应(填反应类型)写出第一步的化学方程式
(填该物质的电子式)③加成反应(填反应类型)写出第一步的化学方程式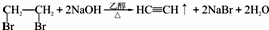 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示:
A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示: CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去苯中的少量溴:加入CCl4萃取后分液 | |
| B. | 除去乙烷中的乙烯:通入酸性高锰酸钾溶液中 | |
| C. | 除去CO2中的少量HCl气体:通过盛有饱和Na2CO3溶液的洗气瓶 | |
| D. | 除去FeCl2溶液中的少量FeCl3:加入足量Fe粉后过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com