
【题目】NH3和HNO3是重要的工业产品,下图为合成氨以及氨氧化制硝酸的流程。

(1)合成塔中发生反应的化学方程式是_______________________________
从氨分离器中又回到合成塔中的物质是_________________。
(2)氧化炉中发生反应的化学方程式是_________________________________________
(3)尾气中的少量NO、NO2可以用NH3来处理,在催化剂作用下生成无污染的气体,写出NO2和 NH3反应的化学方程式__________________________________________________
当有5.6L NO2被还原时,转移电子的物质的量为 ________________mol.
(4)氧化炉中出来的气体,先降温再进入吸收塔,吸收塔中通入空气的作用是_________________.若进入吸收塔的气体的体积分数为NO210.0%,NO 1.32%,其余为N2、水蒸气等.当进入吸收塔中气体为10m3时,最少需要空气的体积为_____________m3。
【答案】 N2+3H2 ![]() 2NH3 N2和H2 4NH3+5O2
2NH3 N2和H2 4NH3+5O2![]() 4NO+6H2O 8NH3+6NO2
4NO+6H2O 8NH3+6NO2 ![]() 7N2+12H2O 1 mol 使NO、NO2完全转化为HNO 3 1.66
7N2+12H2O 1 mol 使NO、NO2完全转化为HNO 3 1.66
【解析】(1)合成塔中发生的反应是氮气和氢气的化合反应,反应的化学方程式是N2+3H2 ![]() 2NH3;由于是可逆反应,因此为了提高原料的利用率,从氨分离器中又回到合成塔中的物质是N2和H2;(2)氧化炉中反生的反应是氨气的催化氧化,则反应的化学方程式是4NH3+5O2
2NH3;由于是可逆反应,因此为了提高原料的利用率,从氨分离器中又回到合成塔中的物质是N2和H2;(2)氧化炉中反生的反应是氨气的催化氧化,则反应的化学方程式是4NH3+5O2![]() 4NO+6H2O;(3)尾气中的少量NO、NO2可以用NH3来处理,在催化剂作用下生成无污染的气体,因此生成的气体是氮气和二氧化碳,则NO2和NH3反应的化学方程式为8NH3+6NO2
4NO+6H2O;(3)尾气中的少量NO、NO2可以用NH3来处理,在催化剂作用下生成无污染的气体,因此生成的气体是氮气和二氧化碳,则NO2和NH3反应的化学方程式为8NH3+6NO2 ![]() 7N2+12H2O;反应中氮元素的化合价从+4价降低到0价,因此当有5.6LNO2被还原时,即0.25molNO2被还原,则转移电子的物质的量为1mol;(4)为提高原料的利用率,则氧化炉中出来的气体,先降温再进入吸收塔,因此吸收塔中通入空气的作用是使NO2和NO全部转化为HNO3;二氧化氮和一氧化氮的体积分别是1 m3和0.132 m3,根据电子得失守恒可知需要氧气的体积是
7N2+12H2O;反应中氮元素的化合价从+4价降低到0价,因此当有5.6LNO2被还原时,即0.25molNO2被还原,则转移电子的物质的量为1mol;(4)为提高原料的利用率,则氧化炉中出来的气体,先降温再进入吸收塔,因此吸收塔中通入空气的作用是使NO2和NO全部转化为HNO3;二氧化氮和一氧化氮的体积分别是1 m3和0.132 m3,根据电子得失守恒可知需要氧气的体积是![]() ,所以需要空气的体积是
,所以需要空气的体积是![]() 。
。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法不正确的是
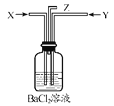
A. 洗气瓶中产生的沉淀是碳酸钡 B. 在Z导管出来的气体中有二氧化碳
C. 洗气瓶中产生的沉淀是硫酸钡 D. 在Z导管口有红棕色气体出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45s时,达到平衡(NO2浓度约为0.0125molL﹣1).如图中的曲线表示二氧化氮分解反应在前25s内的反应进程. 
(1)写出反应的化学方程式 .
(2)在10s内氧气的反应速率 .
(3)若反应延续至70s,请在图中用实线画出25s至70s的反应进程曲线;
(4)若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出加催化剂的反应进程曲线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在原电池和电解池的电极上所发生的反应,属于还原反应的是( )
A.原电池的正极和电解池的阳极所发生的反应
B.原电池的正极和电解池的阴极所发生的反应
C.原电池的负极和电解池的阳极所发生的反应
D.原电池的负极和电解池的阴极所发生的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙固体是登山运动员常用的能源提供剂.某兴趣小组拟选用如下装置制备氢化钙. 
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为(填仪器接口的字母编号);
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;(请按正确的顺序填入下列步骤的标号);
A.加热反应一段时间
B.收集气体并检验其纯度
C.关闭分液漏斗活塞
D.停止加热,充分冷却
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此推断,上述实验确有CaH2生成. ①写出CaH2与水反应的化学方程式;
②该同学的判断不正确,原因是(用相关化学方程式表示) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铁制品上镀上一定厚度的铜层,以下电镀方案中正确的是( )
A.铜作阳极,铁制品作阴极,溶液中含Fe2+
B.铜作阴极,铁制品作阳极,溶液中含Cu2+
C.铜作阴极,铁制品作阳极,溶液中含Fe3+
D.铜作阳极,铁制品作阴极,溶液中含Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l)HCOOH(l)+CH3OH(l)△H>0某温度下,V L混合体系中各组分的起始量如下表,HCOOCH3转化率随反应时间t的变化如图(假设混合体系体积不变).下列说法正确的是( )
组分 | 物质的量/mol |
HCOOCH3 | 1.00 |
H2O | 1.99 |
HCOOH | 0.01 |
CH3OH | 0.52 |

A.温度升髙,该反应的平衡常数减小
B.010min,HCOOCH3的平均反应速率v=0.003molL﹣1min﹣1
C.HCOOCH3水解平均反应速率先是增大,后减小,最后保持不变
D.该条件下达到平衡状态,反应物转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL 混合溶液中,HNO3和 H2SO4的物质的量浓度分别是0.1mol/L,0.4mol/L向该混合液中加入 2.56g铜粉,加热待充分反应后,所得溶液中 Cu2+的物质的量浓度是mol/L (假设溶液体积不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com