
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.遇苯酚变紫色的溶液:Na+、Mg2+、SO 、Cl-
、Cl-
B.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、MnO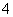
C.使甲基橙变红色的溶液:NH 、Cu2+、ClO-、Cl-
、Cu2+、ClO-、Cl-
D. 0.1mol·L-1 NaHCO3溶液:K+、AlO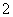 、Cl-、NO
、Cl-、NO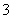
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
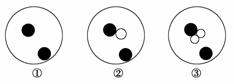
简单原子的原子结构可用如下图的表示方法形象地表示:其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的是( )
A.①②③互为同位素
B.①②③都为氢元素的一种核素
C.①②③是三种化学性质不同的粒子
D.①②③具有相同的质量数
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2和Cl2都是有漂白作用的物质,若将等物质的量的这两种气体混合,同时作用潮湿的红布条,可观察到的现象是( )
A、慢慢褪色 B、立即褪色
C、先褪色后复色 D、不褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各反应不属于可逆反应的是( )。
A.SO2与H2O反应生成H2SO3 B.H2O分解生成H2和O2
C.SO2和O2反应生成SO3 D.H2与I2反应生成HI
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制取SO2的反应原理为:
Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
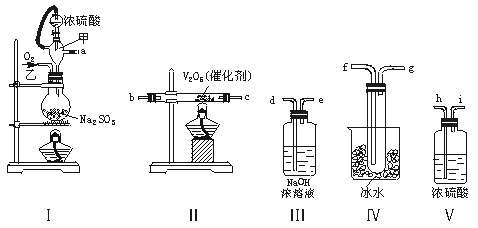
(1)这些装置的连接顺序(按气体左右的方向)是_____________→_____________→_____________→_____________→
_____________→_____________→_____________→_____________(填各接口的编号)。
(2)实验时甲仪器的作用与原理是_____________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是_____________。
(4)Ⅳ处观察到的现象是_____________。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会_____________(填“增大”“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
电解法处理含铬(六价铬)废水的原理如图所示,阳极区溶液中的离子反应是Cr2O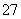 +6Fe2++14H+ == 2Cr3+ +6Fe3+ 7H2O。下列说法正确的是
+6Fe2++14H+ == 2Cr3+ +6Fe3+ 7H2O。下列说法正确的是
A.电解槽中H+向阳极移动
B.阳极的电极反应式是:Fe-3e-= Fe3+
C.电解一段时间后,阴极区溶液的pH升高
D.阳极的铁板可用石墨代替
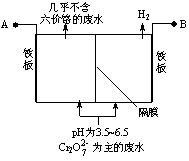
查看答案和解析>>
科目:高中化学 来源: 题型:
向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g) 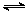 xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示:
| 容器 | 甲 | 乙 |
| 容积(L) | 0.5 | 0.5 |
| 反应放热(kJ) | Q1 | Q2 |
| 反应物起始量 | 1 molA 1 molB | 0.5 molA 0.5 molB |

下列说法正确的是
A.x=1 B.Q1>2Q2 C.根据题中信息无法计算a值
D.保持其他条件不变,起始时向乙容器充入0.2 mol A、0.2 mol B、0.2 mol C,则此时v(正)> v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
对于某些物质或离子的检验及结论一定正确的是( )
A.某物质的水溶液使红色石蕊试纸变蓝,该物质一定是碱
B.某气体能使湿润淀粉碘化钾试纸变蓝,该气体一定是氯气
C.某物质的水溶液中加入盐酸产生无色无味气体,该溶液一定含有碳酸根离子
D.往铁和稀硝酸反应后的溶液中滴入KSCN溶液,溶液显血红色,则该反应后的溶液中肯定有Fe3+,可能还有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
MnCl2+Cl2↑+2H2O,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
请回答下列问题:
①写出该反应的离子反应方程式_________________________,②反应中被氧化的HCl的物质的量为 ________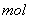 。③实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸的物质的量浓度_________
。③实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸的物质的量浓度_________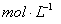 。
。
|
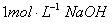 溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。
溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。 ①合金中镁的质量 g。
②盐酸的物质的量浓度 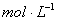 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com