
(除标注外,每空2分,共8分)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:

(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是__ __。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是__ _。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:
____。
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值。涉及反应如下(均未配平):
NiOOH+Fe2++H+——Ni2++Fe3++H2O
Fe2++MnO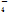 +H+——Fe3++Mn2++H2O
+H+——Fe3++Mn2++H2O
则x=____;y=__。
科目:高中化学 来源:2015-2016学年辽宁省高二上12月月考化学试卷(解析版) 题型:实验题
环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:
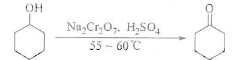
环己醇、环己酮和水的部分物理性质见下表:
物质 | 沸点(℃) | 密度(g-cm-3,200C) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
环己酮 | 155.6(95)* | 0.9478 | 微溶于水 |
水 | 100.0 | 0.9982 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55-60℃进行反应。反应完成后,加入适量水,蒸馏,收集95-100℃的馏分,得到主要的含环己酮和水的混合物。
①酸性Na2Cr2O7溶液的加料方式为 。
②蒸馏不能分离环己酮和水的原因是 。
(2)环己酮的提纯需要经过以下一系列的操作:
a蒸馏,收集151-156℃的馏分;b 过滤;c 在收集到的馏分中加NaCl固体至饱和,静置,分液;d 加入无水MgSO4固体,除去有机物中少量水。
①上述操作的正确顺序是 (填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需 。
③在上述操作c中,加入NaCl固体的作用是 。
(3)利用红外光谱图,可确定环己酮分子含官能团名称
查看答案和解析>>
科目:高中化学 来源:2016届广西河池市高三上第五次月考理综化学试卷(解析版) 题型:填空题
“低碳循环”引起了全世界的高度重视,减排CO2的一种方法是:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
(1)500℃时有容积为2L的密闭容器中充入2mol CO2和6mol H2,测得CO2和CH3OH的物质的量随时间变化如图所示。
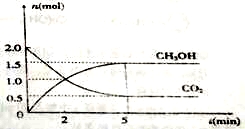
①反应的ΔS (填“>”或“<”)0,从反应开始到平衡,H2的平均反应速率:
υ(H2)=__________mol/(L·s)。
②该反应的平衡常数K=__________(保留二位有效数字);平衡时H2的转化率为________。
③将上述平衡体系的温度升高至700℃,平衡常数K=5.01,则ΔH 0(填“>”或“<”或“﹦”);为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有 __________(填序号)。
a.升高温度 b.缩小容器的容积 c.使用合适的催化剂 d.再充入CO2气体
(2)已知:①H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1
③2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1257.5 kJ·mol-1
写出液态甲醇不完全燃烧生成CO气体和液态H2O的热化学方程式:
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
标准状况下,将体积为V L的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg·cm-3。下列说法错误的是

A.水最终会充满整个烧瓶
B.所得溶液的物质的量浓度为1/22.4 mol·L-1
C.所得溶液的质量分数为17/22400ρ
D.所得溶液中,n(NH3·H2O)+n(NH4+)=V/22.4 mol
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
“纳米技术”广泛应用于催化及军事科学中,“纳米技术”是指粒子直径在几纳米到几十纳
米的材料。如将“纳米材料”分散到液体分散剂中,所得的混合物具有的性质是
A.能全部通过半透膜 B.能发生丁达尔现象
C.一定能导电 D.一定为悬浊液或乳浊液
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上月考化学试卷(解析版) 题型:选择题
下列物质的制备与工业生产相符的是( )
①NH3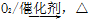 NO
NO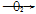 NO2
NO2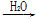 HNO3
HNO3
②浓HCl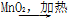 Cl2
Cl2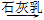 漂白粉
漂白粉
③MgCl2(aq) 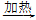 无水MgCl2
无水MgCl2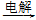 Mg
Mg
④饱和NaCl(aq) 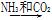 NaHCO3
NaHCO3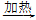 Na2CO3
Na2CO3
⑤铝土矿 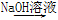 NaAlO2溶液
NaAlO2溶液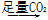 Al(OH)3
Al(OH)3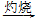 Al2O3
Al2O3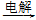 Al
Al
A.①④⑤ B.①③⑤ C.②③④ D.②④⑤
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上月考化学试卷(解析版) 题型:选择题
下列各组离子能在指定环境中大量共存的是( )
A.在c(HCO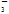 )=0.1 mol·L-1的溶液中:NH
)=0.1 mol·L-1的溶液中:NH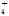 、AlO
、AlO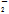 、Cl-、NO
、Cl-、NO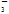
B.在由水电离出的c(H+)=1×10-12 mol·L-1的溶液中:Fe2+、ClO-、Na+、SO
C.在加入铝粉产生H2的溶液中:SO 、NO
、NO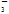 、Na+、NH
、Na+、NH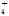
D.在使红色石蕊试纸变蓝的溶液中:SO 、CO
、CO 、Na+、K+
、Na+、K+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省普宁市高一上学期第三次月考化学试卷(解析版) 题型:选择题
下列我国古代的技术应用中,其工作原理不涉及化学反应的是
A.火药使用 | B.粮食酿酒 | C.转轮排字 | D.铁的冶炼 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省温州市高一上学期期中测试化学试卷(解析版) 题型:选择题
某盐的混合物中含有0.2mol Na+,0.4mol Mg2+,0.4mol Cl-,则SO42-为
A.0.1mol B.0.5mol C.0.3mol D.0.15mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com