
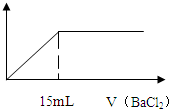
 在10mL 0.05mo1/L的某金属硫酸盐溶液中,滴加0.1mo1/L BaCl2溶液,生成沉淀质量与加入BaCl2溶液体积关系如图所示,10mL该硫酸盐与足量的氢氧化钠完全反应生成10-3 mol沉淀,则该金属硫酸盐中金属元素的化合价为( )
在10mL 0.05mo1/L的某金属硫酸盐溶液中,滴加0.1mo1/L BaCl2溶液,生成沉淀质量与加入BaCl2溶液体积关系如图所示,10mL该硫酸盐与足量的氢氧化钠完全反应生成10-3 mol沉淀,则该金属硫酸盐中金属元素的化合价为( )| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
分析 设该硫酸盐的化学式为R2(SO4)x,则其化合价为+x价,根据方程式R2(SO4)x+xBaCl2=xBaSO4↓+2RClx计算.
解答 解:设该硫酸盐的化学式为R2(SO4)x,则其化合价为+x价,
10mL 0.05mo1/L的该金属硫酸盐溶液物质的量为0.01L×0.05mo1/L=5×10-4mol,消耗的BaCl2溶液的物质的量为0.015L×0.1mo1/L=1.5×10-3mol,
R2(SO4)x +xBaCl2=xBaSO4↓+2RClx
1 x
5×10-4mol 1.5×10-3mol
解得x=3,即金属元素的化合价为+3价;
故选C.
点评 本题考查了有关方程式的计算,题目难度不大,注意根据反应中方程式的计量数之比等于物质的量之比计算.


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 molN2和1.5 molH2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热为-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3 kJ•mol-1) | |
| D. | 在101 kPa时,2 gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
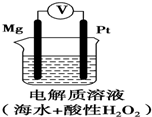 某潜航器使用新型镁-过氧化氢燃料电池系统,其工作原理如图所示.以下说法中错误的是( )
某潜航器使用新型镁-过氧化氢燃料电池系统,其工作原理如图所示.以下说法中错误的是( )| A. | 当电路中有2 mol电子转移时,镁电极的质量减轻24 g | |
| B. | 电池工作时,正极上有H2生成 | |
| C. | 工作过程中溶液的pH会增大 | |
| D. | 电池正极的反应式为H2O2+2e-+2H+═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂在适宜的温度范围时的催化效果更好 | |
| B. | 使用催化剂,可以增大活化分子百分数,加快反应速率 | |
| C. | 催化剂在化学反应前后质量和化学性质不变是因为催化剂不参加化学反应 | |
| D. | 锌与盐酸反应时,加入几滴硫酸铜溶液可加快反应速率,但硫酸铜不作催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molHCl中含有NA个质子 | |
| B. | 0.1mol冰醋酸、0.1mol无水乙醇和浓硫酸混合加热后可得0.1NA个乙酸乙酯分子 | |
| C. | 标准状况下,11.2 L乙醇中所含的碳原子数目为NA | |
| D. | 16g的O2与O3混合物中氧原子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com