
ʵ�����������������������з�����ȡ��4HCl��Ũ����MnO2 Cl2����MnCl2��2H2O�Իش��������⣺
Cl2����MnCl2��2H2O�Իش��������⣺
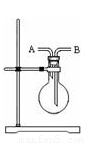
��1���÷�Ӧ�� �����������������ͻ�ԭ�������ʵ���֮��Ϊ ��д���÷�Ӧ�����ӷ���ʽ ��
��2��������ͼװ���ռ�����������Ӧ�� �ڽ��롣
��3�������ж�������������ˮ�����ԣ���д����������ˮ�����ӷ���ʽ
��������������������ж���������������β��ֱ����������У�����Ⱦ������ʵ�����пɲ���NaOH��Һ�������ж�����������ѧ����ʽΪ ��
 ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ʵ�������������������������з�����ȡ�ģ�
ʵ�������������������������з�����ȡ�ģ�
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ʵ�������������������������з�����ȡ�ģ�
ʵ�������������������������з�����ȡ�ģ�
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��ɽ������ƽ��һ�и�һ��ѧ����ĩ��⻯ѧ�Ծ��������棩 ���ͣ������
��12�֣�ijͬѧ��10mol• L-1 ��Ũ��������250mL 1mol• L-1 ��ϡ���ᣬ�������й�ʵ�顣��ش��������⣺
��1����Ҫ��ȡŨ����____________mL��
��2�����Ƹ�ϡ����ʱʹ�õ���������Ͳ���ձ����������⣬�������õ���������________________��___________��
��3��ʵ�����������������������з�����ȡ��4HCl��Ũ����MnO2 Cl2����MnCl2��2H2O��
Cl2����MnCl2��2H2O��
�Իش��������⣺
�÷�Ӧ��_____________��������������������_______________��
��������״���µ�Cl2 2.24L,��������HCl__________mol��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com