
分析 (1)氯气与水反应生成盐酸和次氯酸,HCl具有酸性,HClO具有漂白性;
(2)钠与水反应生成氢氧化钠和氢气,氢氧化钠与铵根离子反应生成氨气和水;
(3)加入Ba(OH)2溶液至中性时,其反应式为:2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,以此书写离子方程式;至中性时溶液中溶质只有Na2SO4,加入Ba(OH)2溶液生成BaSO4沉淀.
解答 解:(1)氯气与水反应生成盐酸和次氯酸,HCl具有酸性,能够使紫色石蕊溶液变红,HClO具有强氧化性,能够使溶液褪色,所以使溶液变红和褪色的微粒分别是H+、HClO,故答案为:H+;HClO;
(2)第一步反应为钠与水反应生成氢氧化钠和氢气,第二步反应为铵根离子与氢氧根离子反应生成氨气,反应的离子方程式为NH4++OH-═NH3↑+H2O
故答案为:NH4++OH-═NH3↑+H2O;
(3)NaHSO4是二元强酸的酸式盐,可以理解为全部电离.当反应后溶液呈中性时,其反应式为:2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,则离子反应方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;此时溶液中溶质只有Na2SO4,加入Ba(OH)2的离子反应方程式为Ba2++SO42-=BaSO4↓,
故答案为:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O;Ba2++SO42-═BaSO4↓.
点评 本题考查离子方程式的书写,题目难度中等,注意根据物质的量判断反应的程度并书写相关离子方程式,注意与量有关的离子方程式的书写方法.


科目:高中化学 来源: 题型:填空题
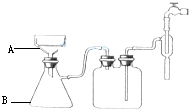 按要求完成硝酸钾晶体的制备实验:
按要求完成硝酸钾晶体的制备实验:| 步骤 | 操作 | 具体操作步骤 | 现象解释结论等 |
① | 溶解 | 取20克KNO3和17克NaCl溶解在35ml水中,加热至沸,并不断搅拌. | 固体溶解 |
| ② | 蒸发 | 继续加热搅拌,使溶液蒸发浓缩. | 有a晶体析出. |
| ③ | 热过滤 | 当溶液体积减少到约原来的一半时,迅速趁热过滤 | 滤液中的最主要成分为b. |
| ④ | 冷却 | 将滤液冷却至室温. | 有晶体析出. |
| ⑤ | 按有关要求进行操作 | 得到初产品硝酸钾晶体 | |
⑥ | 将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤. | 得到纯度较高的硝酸钾晶体 | |
| ⑦ | 检验 | 分别取⑤、⑥得到的产品,配置成溶液后分别加入1滴1mol/l的HNO3和2滴0.1mol/l的AgNO3 | 可观察到⑤、⑥产品中出现的现象分别是⑤产品中产生白色沉淀,⑥产品中无明显现象. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铁在高温下与一氧化碳反应 | |
| B. | 二氧化碳与氢氧化钠溶液作用生成碳酸钠 | |
| C. | Zn 粒与稀硫酸反应制取氢气 | |
| D. | 碳酸钠溶液与石灰乳混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 实验室中用含有Ca2+、Mg2+、Cl-的自来水制取蒸馏水,可采用蒸馏的方法 | |
| B. | 用CCl4萃取碘水的实验中,振荡静置后,下层为紫红色溶液 | |
| C. | 利用植物油的密度比水小的原理,可用分液的方法分离这两种液体混合物 | |
| D. | 蒸馏时,温度计的水银球应充分接触溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴水褪色是因为发生了加成反应 | |
| B. | 苯的邻位二元取代物只有一种,可以说明苯分子不具有碳碳单键和碳碳双键的交替结构 | |
| C. | 乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同 | |
| D. | 苯乙烯( -CH=CH2)与立方烷( -CH=CH2)与立方烷( )互为同分异构体 )互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中滴加盐酸能产生无色气体,该气体能使澄清石灰水变浑浊,则原溶液中一定含CO32- | |
| B. | 向某溶液中加入BaCl2溶液出现白色沉淀,则该溶液中肯定有SO42- | |
| C. | 向某溶液中加入NaOH溶液后再加热,若产生的气体能使湿润红色石蕊试纸变蓝,则该溶液中肯定有NH4+ | |
| D. | 用焰色反应可鉴别出NaCl、KCl和Na2SO4三种物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com