
| A�� | ������Ӧ�ﵽƽ����������������������£�ֻ�ı�ѹǿ��ƽ�ⲻ�ƶ� | |
| B�� | �÷�Ӧ�Ļ�ѧƽ�ⳣ��ΪK=$\frac{c��C��{c}^{3}��D��{c}^{4}��E��}{c��A��c��B��}$ | |
| C�� | E���� | |
| D�� | �÷�Ӧ���Ȼ�ѧ����ʽ 2A��g��+B��g��?C��g��+3D��l��+4E��g����H=-QkJ/mol |
���� �ﵽƽ�������A��Ũ�ȼ���һ�룬��A��Ӧ1mol����
2A+B?C+3D+4E
��ʼ��mol�� 2 1 0 0 0
ת����mol�� 1 0.5 0.5 1.5 2
ƽ�⣨mol�� 1 0.5 0.5 1.5 2
����ͬ���¶��²�÷�Ӧǰ��ѹǿ�ֱ�Ϊ6.06��106��8.08��106Pa������������������ʵ���Ϊx����$\frac{1.5+x}{3}$=$\frac{8.08��1{0}^{6}}{6.06��1{0}^{6}}$��x=2.5����C��EΪ���壬DΪҺ�壬�Դ˽����⣮
��� �⣺�ﵽƽ�������A��Ũ�ȼ���һ�룬��A��Ӧ1mol����
2A+B?C+3D+4E
��ʼ��mol�� 2 1 0 0 0
ת����mol�� 1 0.5 0.5 1.5 2
ƽ�⣨mol�� 1 0.5 0.5 1.5 2
����ͬ���¶��²�÷�Ӧǰ��ѹǿ�ֱ�Ϊ6.06��106��8.08��106Pa������������������ʵ���Ϊx����$\frac{1.5+x}{3}$=$\frac{8.08��1{0}^{6}}{6.06��1{0}^{6}}$��x=2.5����C��EΪ���壬DΪҺ�壬
A����Ӧǰ������ļ�����֮�Ͳ��ȣ�������ѹǿƽ�ⷢ���ƶ�����A����
B��DΪҺ�壬�÷�Ӧ�Ļ�ѧƽ�ⳣ��ΪK=$\frac{c��C��{c}^{4}��E��}{{c}^{2}��A��c��B��}$����B����
C�������Ϸ�����֪EΪ���壬��C��ȷ��
D��A��Ӧ0.5mol����Ӧ���ų�����Q kJ����DΪҺ�壬����Ϊ���壬�Ȼ�ѧ����ʽΪ2A��g��+B��g��?C��g��+3D��l��+4E��g����H=-2QkJ/mol����D����
��ѡC��
���� ���⿼���˻�ѧƽ����йؼ��㣬Ϊ��Ƶ���㣬������ѧ���ķ��������ͼ��������Ŀ��飬�ѶȲ�����ȷ������ʽ�����ǻ�ѧƽ����㳣�õĽ��ⷽ����Ӧ�������գ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
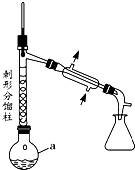 �����������н�����ʹ���ã��ǽ���ʹ�õĽ�����ʹҩ���С����ȱ���֮�ƣ����Ʊ�ԭ�����£�
�����������н�����ʹ���ã��ǽ���ʹ�õĽ�����ʹҩ���С����ȱ���֮�ƣ����Ʊ�ԭ�����£� +CH3COOH$\stackrel{��}{?}$
+CH3COOH$\stackrel{��}{?}$ +H2O
+H2O| ���� | �۵� | �е� | �ܽ�� |
| �������� | 114.3�� | 305�� | ������ˮ����������ˮ |
| ���� | -6�� | 184.4�� | ����ˮ |
| ���� | 16.6�� | 118�� | ������ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
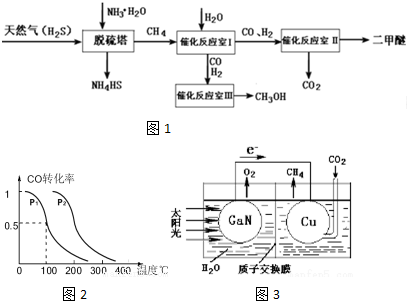
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| �¶�/�� | 700 | 800 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A�� | 4 sʱc��B��Ϊ0.38 mol/L | |
| B�� | 830���ƽ��ʱ��A��ת����Ϊ80% | |
| C�� | ��Ӧ��ƽ��������¶ȣ�ƽ�������ƶ� | |
| D�� | 1200��ʱ��ӦC��g��+D��g��?A��g��+B��g����ƽ�ⳣ����ֵΪ2.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
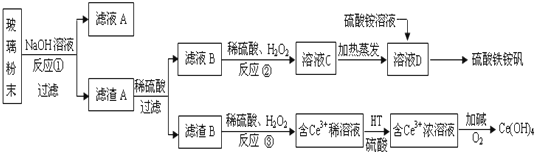
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ܢ� | B�� | �٢ڢ� | C�� | �ڢۢ� | D�� | �٢ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
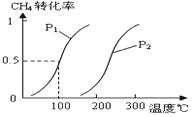 �״�����Ϊ2l���͵�����ȼ�ϣ���ҵ��ͨ�����з�Ӧ��͢���CH4��H2OΪԭ�����Ʊ��״���
�״�����Ϊ2l���͵�����ȼ�ϣ���ҵ��ͨ�����з�Ӧ��͢���CH4��H2OΪԭ�����Ʊ��״����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �٢� | C�� | �ڢ� | D�� | �ڢ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com