
| A、9.3×10-5 mol/L |
| B、9.7×10-9 mol2/L2 |
| C、7.6×10-17 mol4/L4 |
| D、8.7×10-9 mol2/L2 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-1076.7 kJ/mol | ||||
B、N2H4(g)+
| ||||
| C、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-542.7 kJ/mol | ||||
| D、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-1059.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体中一定有甲烷 |
| B、混合气体一定是甲烷和乙烯 |
| C、混合气体中一定没有乙炔 |
| D、混合气体中一定有丙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
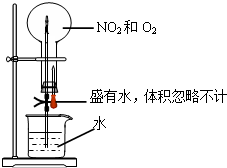 用如图所示的装置做喷泉实验,该实验条件下的气体摩尔体积为a L/mol,且不考虑2NO2?N2O4.最终液体充满了烧瓶,则烧瓶内溶液的物质的量浓度约是( )
用如图所示的装置做喷泉实验,该实验条件下的气体摩尔体积为a L/mol,且不考虑2NO2?N2O4.最终液体充满了烧瓶,则烧瓶内溶液的物质的量浓度约是( )A、
| ||
B、
| ||
C、
| ||
| D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L1mol/LAlCl3溶液中 |
| B、2L1mol/LFeCl3溶液中 |
| C、1L2mol/LKCl溶液中 |
| D、2L3mol/LMgCl2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、难溶电解质的溶度积越小,溶解度越大 |
| B、可以通过沉淀反应使杂质离子完全沉淀 |
| C、难溶电解质的溶解达到平衡后就静止不动了 |
| D、一定浓度的NH4Cl溶液可以溶解Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不能确定有无AgI沉淀生成 |
| B、没有AgI沉淀生成 |
| C、有KNO3晶体析出 |
| D、有AgI沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纯铜作阳极,含Zn和Ag的铜合金作阴极 |
| B、含Zn和Ag的铜合金作阳极,纯铜作阴极 |
| C、用纯铁作阳极,纯铜作阴极 |
| D、用石墨作阳极,纯铜作阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在稀溶液中,1mol酸和1mol碱完全反应所放出的热量,叫做中和热 |
| B、热化学方程式中,各物质前的化学计量数不表示分子个数 |
| C、在101kPa时,1mol物质燃烧时所放出的热量叫做该物质的燃烧热 |
| D、如果反应物所具有的总能量小于生成物所具有的总能量,则反应放热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com