
【题目】二氧化碳的利用是我国能源领域的一个重要战略方向,目前我国科学家在以下方面已经取得重大成果。
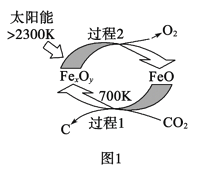
(1)图1是由CO2制取C的太阳能工艺。已知过程1发生的反应中![]() =6,则FexOy的化学式为__。过程1生成1molC的反应热为△H1;过程2产生lmolO2(g)的反应热为△H2。则由CO2制取C的热化学方程式为__。
=6,则FexOy的化学式为__。过程1生成1molC的反应热为△H1;过程2产生lmolO2(g)的反应热为△H2。则由CO2制取C的热化学方程式为__。
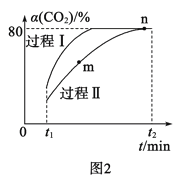
(2)利用CO2合成甲醇的反应为:CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ΔH=-53.7kJ·mol-1,一定条件下,将1molCO2和2.8molH2充入容积为2L的绝热密闭容器中,发生上述反应。CO2的转化率[α(CO2)]在不同催化剂作用下随时间的变化曲线如图2所示。过程Ⅰ的活化能__(填“>”“<”或“=”)过程Ⅱ的活化能,n点的平衡常数K=__。
H2O(g)+CH3OH(g) ΔH=-53.7kJ·mol-1,一定条件下,将1molCO2和2.8molH2充入容积为2L的绝热密闭容器中,发生上述反应。CO2的转化率[α(CO2)]在不同催化剂作用下随时间的变化曲线如图2所示。过程Ⅰ的活化能__(填“>”“<”或“=”)过程Ⅱ的活化能,n点的平衡常数K=__。
(3)用二氧化碳合成低密度聚乙烯(LDPE)。以纳米二氧化钛膜为工作电极,常温常压电解CO2,可制得LDPE,该电极反应可能的机理如图3所示。
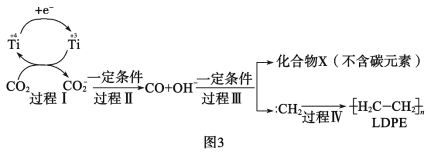
①过程Ⅰ~Ⅲ中碳元素发生__反应(填“氧化”或“还原”)。
②请补充完整并配平CO2转化为LDPE的电极反应:2nCO2+___+___=![]() +___。__
+___。__
③工业上生产1.4×104g的LDPE,理论上需要标准状况下CO2的体积是__L。
【答案】Fe3O4 CO2(g)=C(s)+O2(g) △H=△H1+△H2 < 200 还原 2nCO2+12ne-+12nH+=![]() +4nH2O 2.24×104
+4nH2O 2.24×104
【解析】
(1)根据![]() =6可写出反应的化学方程式:6FeO+CO2===FexOy+C,根据原子守恒知x∶y=3∶4;由盖斯定律计算可得;
=6可写出反应的化学方程式:6FeO+CO2===FexOy+C,根据原子守恒知x∶y=3∶4;由盖斯定律计算可得;
(2)反应活化能越小,反应速率越快;由题意可以建立三段式计算可得热化学方程式;
(3)①由题给示意图可知,过程Ⅰ~Ⅲ中碳元素发生如下转化CO2→CO2-→CO→∶CH2,碳元素的化合价的变化为+4→+3→+2→-2;
②CO2转化为LDPE时碳元素的化合价由+4降到-2价,每个碳原子得6个电子,则2n个CO2共得12n个电子;
③据2nCO2~![]() 计算可得标准状况下CO2的体积。
计算可得标准状况下CO2的体积。
(1)根据![]() =6可写出反应的化学方程式:6FeO+CO2===FexOy+C,根据原子守恒知x∶y=3∶4,则FexOy的化学式为Fe3O4;由盖斯定律可知,过程1+过程2可得CO2制取C的热化学方程式CO2(g)=C(s)+O2(g),则△H=△H1+△H2,故答案为:Fe3O4;CO2(g)=C(s)+O2(g) △H=△H1+△H2;
=6可写出反应的化学方程式:6FeO+CO2===FexOy+C,根据原子守恒知x∶y=3∶4,则FexOy的化学式为Fe3O4;由盖斯定律可知,过程1+过程2可得CO2制取C的热化学方程式CO2(g)=C(s)+O2(g),则△H=△H1+△H2,故答案为:Fe3O4;CO2(g)=C(s)+O2(g) △H=△H1+△H2;
(2)反应活化能越小,反应速率越快,由题给示意图可知,过程Ⅰ先达到平衡,反应速率快于过程Ⅱ,则过程Ⅰ的活化能小于过程Ⅱ的活化能;由图可知CO2的转化率为80%,反应消耗二氧化碳的浓度为0.4mol/L,由题意可以建立如下三段式:

则平衡常数K=![]() =200,故答案为:<;200;
=200,故答案为:<;200;
(3)①由题给示意图可知,过程Ⅰ~Ⅲ中碳元素发生如下转化CO2→CO2-→CO→∶CH2,碳元素的化合价的变化为+4→+3→+2→-2,均为碳被还原的过程,故碳元素均发生还原反应,故答案为:还原;
②CO2转化为LDPE时碳元素的化合价由+4降到-2价,每个碳原子得6个电子,则2n个CO2共得12n个电子,电极反应反应式为2nCO2+12ne-+12nH+=![]() +4nH2O,故答案为:2nCO2+12ne-+12nH+=
+4nH2O,故答案为:2nCO2+12ne-+12nH+=![]() +4nH2O;
+4nH2O;
③生产1.4×104 g ![]() ,即生产1.4×104g
,即生产1.4×104g![]() ,据2nCO2~
,据2nCO2~![]() ,可知CO2的物质的量为
,可知CO2的物质的量为![]() =1.0×103mol,标准状况下CO2的体积等于1.0×103mol×22.4L/mol=2.24×104L,故答案为:2.24×104。
=1.0×103mol,标准状况下CO2的体积等于1.0×103mol×22.4L/mol=2.24×104L,故答案为:2.24×104。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是

A. 0.1 mol·L-1 HR溶液的pH为5
B. HR为弱酸,常温时随着氨气的通入,c(R-)/[c(OH-).c(HR)] 逐渐增大
C. 当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 当c(R-)= c(HR)时,溶液必为中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,分别向浓度均为0.1 mol/L,体积均为20 mL的HX和HY的溶液中滴入等物质的量浓度的氨水,溶液中水电离出的c(H+)与加入氨水的体积变化关系如图所示。下列说法正确的是

A. HX的电离方程式为HX![]() H++X
H++X
B. b点时溶液中c(![]() )=c(Y)>c(H+)=c(OH)
)=c(Y)>c(H+)=c(OH)
C. HX的电离平衡常数约为1×107 mol/L
D. a、b两点对应溶液中存在的微粒种类数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2022年前后我国将建成首座载人空间站。为实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家研发了一种能量转化装置,总反应方程式为2CO2=2CO+O2。下列说法正确的是( )
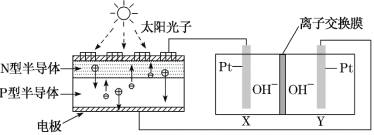
A.该装置将太阳能直接转化为化学能
B.离子交换膜为阳离子交换膜
C.反应完毕,该装置中电解质溶液的pH不变
D.Y电极的反应:CO2+2e-+H2O=CO+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据电解饱和食盐水的实验内容填写:
(1) 阳极与电源的__极(选填正或负)相连;阳极产生_(填化学式)气体;它的检验方法是__。
(2)阳极发生___反应;阴极发生__反应(选填氧化或还原)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甘油酯GMA(![]() ),由于本身带有丙烯酸酯双键和环氧基团,使得其应用十分广泛。工业合成GMA的一种方法如图(部分反应所需试剂和条件已略去):
),由于本身带有丙烯酸酯双键和环氧基团,使得其应用十分广泛。工业合成GMA的一种方法如图(部分反应所需试剂和条件已略去):

已知:
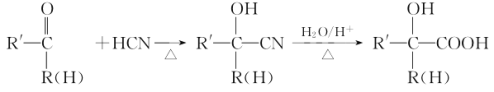
请按要求回答下列问题:
(1)B中的官能团名称:__;
(2)C的结构简式__;
(3)请写出E→F的反应方程式和反应类型:E→F:__,__反应;
(4)H的核磁共振氢谱峰面积之比由大到小为__,H的同分异构体中能发生水解反应的链状化合物有__种。
(5)已知:CH2=CH2![]()
![]() 。参照上述合成路线并结合此信息,以丙烯为原料,完善下列合成有机物C的路线流程图:
。参照上述合成路线并结合此信息,以丙烯为原料,完善下列合成有机物C的路线流程图:![]()
![]() __。
__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物,氢化物晶体的结构有共价型和离子型之分。
(1)氨气是共价型氢化物。工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO-简写为Ac-)。反应方程式为:[Cu(NH3)2]Ac +CO+NH3![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①写出铜原子的价电子轨道表示式_________。
②氨分子的空间构型为_________;氨气极易溶于水是因为_________;氨水中各元素原子的电负性从大到小排列顺序为_________。
③醋酸分子中,碳原子的杂化方式是___________。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有_________。
a 离子键b 配位键c σ键d π键
(2)某离子型氢化物化学式为XY2,晶胞结构如图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。
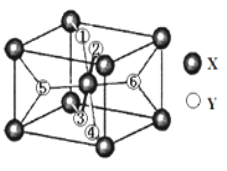
①已知1、2、3、4号Y原子在晶胞上、下面上。则5、6号Y原子均在晶胞__________。(填“侧面”或“内部”)
②XY2晶体、硅烷晶体和固态氨3种氢化物熔沸点高低顺序正确的是_______。
a XY2晶体>硅烷晶体>固态氨 b XY2晶体>固态氨>硅烷晶体
c 固态氨>硅烷晶体>XY2晶体 d 硅烷晶体>固态氨>XY2晶体
(3)MgH2是金属氢化物储氢材料,其晶胞如下图所示,该晶体的密度为agcm-3,则晶胞的体积为___________cm3(用含a、NA的代数式表示,NA表示阿伏加德罗常数的值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为一种利用原电池原理设计测定O2含量的气体传感器示意图,RbAg4I5是只能传导Ag+的固体电解质。O2可以通过聚四氟乙烯膜与AlI3 反应生成Al2O 3和I2,通过电池电位计的变化可以测得O2的含量。下列说法正确的是( )
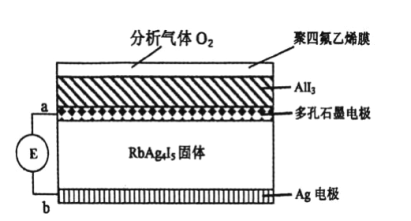
A. 正极反应为:3O2+12e-+4Al3+=2Al2O3
B. 传感器总反应为:3O2+4AlI3+12Ag=2Al2O3+12AgI
C. 外电路转移0.01mol电子,消耗O2的体积为0.56L
D. 给传感器充电时,Ag+向多孔石墨电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义。
(1)海水中无机碳的存在形式及分布如下图所示:用离子方程式表示海水呈弱碱性的原因_________。己知春季海水pH=8.1,预测夏季海水碱性将会_________(填写“增强”或“减弱”),理由是________(写出1条即可)
无机碳 | HCO3- | 90% |
CO32- | 9% | |
CO2 | 1% | |
H2CO3 | ||
其中H2CO3仅为CO2的0.2% | ||

(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g) ![]() CH3OH(g) △H<0,在容积为1L 的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的 起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。下列说法正确的是_________(a、b点横坐标相同,a在曲线T1上,b在曲线T2上)
CH3OH(g) △H<0,在容积为1L 的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的 起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。下列说法正确的是_________(a、b点横坐标相同,a在曲线T1上,b在曲线T2上)
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点(1.5,50)状态下再通入0.5 mol CO和0.5 mol CH3OH,平衡不移动
D.c点状态下再通入1 molCO和4molH2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:

①NO的作用是__________________。
②己知:O3(g)+O(g)=2O2(g) △H =-143kJ·mol-1
反应 1: O3(g)+NO(g) ![]() NO2(g)+O2(g) △H1=-200.2kJ·mol-1
NO2(g)+O2(g) △H1=-200.2kJ·mol-1
反应2:热化学方程式为______________________。
(4)近年来,地下水中的氮污染己成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用 下,密闭容器中的H2可髙效转化酸性溶液中的硝态氮(NO3-)从而降低水体中的氮含量,其工作原理如下图所示
①Ir表面发生反应的方程式为__________________________。
②若导电基体上的Pt颗粒增多,造成的后果是__________________________。

(5)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来精炼银,装置如图所示,甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用,则石墨II附近发生的电极反应式为__________________________。
(6)大气污染物SO 2可用NaOH吸收。已知pKa=-lgKa,25℃时,H2SO3 的 pKa1=1.85, pKa2=7.19。该温度下用 0.1mol·L-1NaOH溶液滴定 20mL0.1mol·L-1H2SO3溶液的滴定曲线如下图所示。b点所得溶液中各离子浓度由大到小的顺序是__________________________;c点所得溶液中:c(Na+)__________3c(HSO3-)(填“>”、“<”或“=”)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com