
【题目】室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元
酸HA,溶液pH的变化曲线如图所示。下列说法正确的是

A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. a、b两点所示溶液中水的电离程度相同
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. b点所示溶液中c(A-)>c(HA)
【答案】D
【解析】
A、a点NaOH与HA物质的量相等,则二者恰好完全反应,生成NaA,反应后溶液的pH为8.7,呈碱性,说明HA为弱酸,NaA发生水解反应,则溶液中c(Na+)>c(A-)>c(HA)>c(H+),A错误;B、a点NaA发生水解反应,促进了水的电离,b点盐酸过量,抑制水的电离,所以a点水的电离程度大于b点,B错误;C、根据电荷守恒,溶液中存在c(H+)+c(Na+)=c(OH)+c(A-),pH=7时,c(H+)=c(OH),因此溶液中:c(Na+)= c(A-),C错误;D、根据图像可知b点HA过量,因为b点溶液pH=4.7,溶液呈酸性,这说明HA的电离程度大于NaA的水解程度,所以c(A-)>c(HA),D正确,答案选D。


科目:高中化学 来源: 题型:
【题目】同温同压下,同体积的氨气(![]() )和硫化氢气体(
)和硫化氢气体(![]() )的质量比为_________;同质量的氨和硫化氢气体的体积比为___________;若二者氢原子数相等,则它们的体积比为___________。(均为前者比后者)
)的质量比为_________;同质量的氨和硫化氢气体的体积比为___________;若二者氢原子数相等,则它们的体积比为___________。(均为前者比后者)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】曾在南充求学和工作过的青年学者孙旭平及其领衔团队,近日成功利用Mo2N纳米催化剂在0.1mol·L1盐酸溶液中进行电催化固氮,装置如图所示,在一定电压下具有较高的产氨速率。下列判断错误的是

A. Mo2N/GCE电极为阴极
B. 溶液中H+通过隔膜向MoN/GCE电极区迁移
C. Mo2N/GCE电极区反应式为N2+6H++6e====2NH3
D. 为提高溶液的导电性,可在石墨电极区加入适量的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.糖类和油脂都是高分子化合物
B.蔗糖和麦芽糖互为同分异构体
C.葡萄糖和果糖互为同系物
D.纤维素可以被人体吸收,并释放能量供人体生命活动需要
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下0.1 mol/L的NaHB(强电解质)溶液中c(H+)>c(OH-),则下列关系一定正确的是( )
A. c(Na+)=c(HB-)+2c(B2-)+c(OH-)
B. c(Na+)=0.1 mol/L≥c(B2-)
C. HB-的水解方程式为HB-+H2O![]() B2-+H3O+
B2-+H3O+
D. 在该盐的溶液中,离子浓度大小顺序为c(Na+)>c(HB-)>c(B2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,a、b、c、d、e、f 均为惰性电极,电解质溶液均足量。接通电源后,d 极附近显红色。下外说法正确的是

A. 电源B 端是正极
B. f 极附近红褐色变深,说明氢氧化铁胶粒带正电
C. 欲用丁装置给铜镀银,N 应为Ag,电解质溶液为AgNO3溶液
D. a、c电极均有单质生成它们的物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷能形成众多单质与化合物。回答下列问题:
(1)磷在成键时,能将一个3s电子激发进入3d能级而参加成键,写出该激发态原子的核外电子排布式__ 。
(2)黑磷是一种二维材料,其中一层的结构如图1所示。
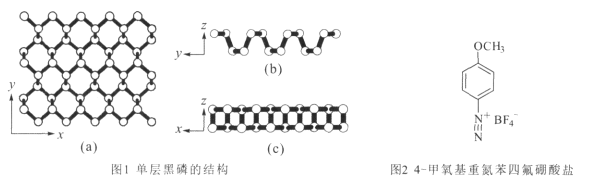
①黑磷中P原子的杂化方式为 _________ 。每一层内P形成六元环彼此相接,平均每个空间六元环中含有的磷原子是 ____个。
②用4-甲氧基重氮苯四氟硼酸盐(如图2)处理黑磷纳米材料,可以保护和控制其性质。
该盐的构成元素中C、N、O、F的电负性由大到小顺序为__,1mol该盐阳离子含有的σ键的数目为______ ,该盐阴离子的几何构型是__。
(3)磷钇矿可提取稀土元素钇(Y),某磷钇矿的结构如下:

该磷钇矿的化学式为__,与PO43—互为等电子体的阴离子有__ (写出两种离子的化学式)。已知晶胞参数a= 0.69 nm,c=0.60 nm,阿伏加德罗常数为NA,则该磷钇矿的密度为__g.cm—3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是评价空气质量的控制标准之一,作为空气污染物的氮氧化物(NOx)常指NO和NO2。
(1)下列关于氮氧化物有关叙述不正确的是:_______(填序号)
①对人体及动物有毒害作用;②造成土壤污染;③一氧化氮可结合血红蛋白造成人体缺氧;④是形成酸雨、酸雾的主要原因之一; ⑤增高大气温度;⑥与碳氢化合物形成光化学烟雾;⑦参与臭氧层的破坏;⑧一氧化氮分子作为一种传递神经信息的 信使分子 ,在使血管扩张,免疫,增强记忆力
(2)用CH4催化还原NOx可在一定程度上消除氮氧化物的污染。
已知:CH4(g)+4NO(g) ![]() 2N2(g)+CO2(g)+2H2O(g)的ΔH=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)的ΔH=-1160kJ·mol-1
2NO2(g)+N2(g) ![]() 4NO(g) ΔH=+293 kJ·mol-1
4NO(g) ΔH=+293 kJ·mol-1
则该条件下,CH4催化还原NO2消除污染的热化学方程式为_______________。
(3)T1℃时,在刚性反应器中以投料比为1:3的NO(g)与O2(g)反应,其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,NO(g)完全反应]。
t/min | 0 | 40 | 80 | 160 | 260 | 700 | ∞ |
p/kPa | 32.8 | 30.7 | 29.9 | 29.4 | 29.2 | 28.8 | 26.9 |
①NO(g)与O2(g)合成的反应速率v=4.2×10-2×p2(NO)×p(O2)(kPa·min-1),t=42 min时,测得体系中p(O2)=22.4 kPa,则此时的v=_________kPa·min-1(计算结果保留1位小数)。
②若降低反应温度至T2℃,则NO(g)与O2(g)完全反应后体系压强p∞(T2℃)_________(填“大于”“等于”或“小于”)26.9kPa,原因是___________________________________。
③T1℃时,反应N2O4(g) ![]() 2NO2(g)的平衡常数Kp=___kPa(Kp为以分压表示的平衡常数,是指平衡时体系中生成气体压强幂之积与反应物气体压强幂之积的比值。计算结果保留3位小数)。
2NO2(g)的平衡常数Kp=___kPa(Kp为以分压表示的平衡常数,是指平衡时体系中生成气体压强幂之积与反应物气体压强幂之积的比值。计算结果保留3位小数)。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(两者物质的量之比为1:1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。

①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南欧紫荆是一种耐碱抗寒的绿化植物,其细胞液浓度很高,有利用根从周围土壤中吸收水分.该植物根细胞中含量最多的物质是( )
A. 蛋白质B. 脂质C. 水D. 无机盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com