
����̼ѭ������������ĸ߶����ӣ���֪ú������ȿ�����ˮ������Ӧ������CO��H2Ϊ���ĺϳ������ϳ����й㷺Ӧ�á��Իش��������⣺
(1)��¯������CO�������Ҫ��;֮һ���������ӦΪ��FeO(s)��CO(g) Fe(s)��CO2(g) ��H��0����֪��1 100 ��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=0.263��
Fe(s)��CO2(g) ��H��0����֪��1 100 ��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=0.263��
���¶����ߣ���ѧƽ���ƶ���ﵽ�µ�ƽ�⣬��ʱƽ�ⳣ��Kֵ (���������С�����䡱)��
��1 100 ��ʱ��ø�¯�У�c(CO2)="0.025" mol��L-1��c(CO)="0.1" mol��L-1��������������£��÷�Ӧ�� ����(����ҡ�)���ж������� ��
(2)Ŀǰ��ҵ��Ҳ����CO2������ȼ�ϼ״����йط�ӦΪ��CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ��H����49.0 kJ��mol-1���������Ϊ1 L���ܱ������У�����1 mol CO2��3 mol H2����Ӧ�����в��CO2��CH3OH(g)��Ũ����ʱ��ı仯��ͼ��ʾ��
CH3OH(g)+H2O(g) ��H����49.0 kJ��mol-1���������Ϊ1 L���ܱ������У�����1 mol CO2��3 mol H2����Ӧ�����в��CO2��CH3OH(g)��Ũ����ʱ��ı仯��ͼ��ʾ��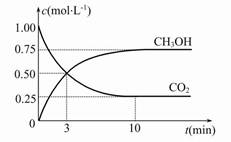
�ٴӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)�� ��
�ڷ�Ӧ�ﵽƽ������д�ʩ��ʹ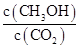 ������� (�����)��
������� (�����)��
| A�������¶� | B���ٳ���H2 | C���ٳ���CO2 | D����H2O(g)����ϵ�з��� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
t ��ʱ����2 mol SO2��1 mol O2ͨ�����Ϊ2 L�ĺ��º����ܱ������У��������·�Ӧ��2SO2(g)��O2(g)  2SO3(g)��2 minʱ��Ӧ�ﵽ��ѧƽ�⣬��ʱ��÷�Ӧ��O2��ʣ��0.8 mol������д���пհף�
2SO3(g)��2 minʱ��Ӧ�ﵽ��ѧƽ�⣬��ʱ��÷�Ӧ��O2��ʣ��0.8 mol������д���пհף�
(1)�ӷ�Ӧ��ʼ����ѧƽ�⣬����SO3��ƽ����Ӧ����Ϊ________��ƽ��ʱSO2ת����Ϊ________��
(2)����������֤���÷�Ӧ�Ѵﵽ��ѧƽ��״̬����(���ţ���ͬ)________��
| A��������ѹǿ���ٷ����仯 |
| B��SO2������������ٷ����仯 |
| C������������ԭ���������ٷ����仯 |
| D����ͬʱ��������2n mol SO2��ͬʱ����n mol O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��һ�������������Ժ�CO2������Ӧ��Fe(s)+CO2(g) FeO(s)+CO(g) ��H>0��
FeO(s)+CO(g) ��H>0��
(1)���д�ʩ����ʹƽ��ʱc(CO)/c(CO2)������� (�����)��
A.�����¶� B.����ѹǿ
C.����һ�������� D.�ټ���һЩ����
(2)��Ӧ�ﵽƽ��������������������ʱ����ͨ��һ������CO2��ʹCO2��Ũ�ȳ�Ϊԭ����2������CO2��ת���ʽ� (���������С�����䡱)��
����һ���¶��µ�ij�ݻ��ɱ���ܱ������У��������л�ѧƽ�⣺C(s)+H2O(g)  CO(g)+H2(g)���Է����ͻش��������⣺
CO(g)+H2(g)���Է����ͻش��������⣺
(1)���϶��������淴Ӧ��һ���������Ѵﵽ��ѧƽ��״̬���� (ѡ�����)��
A����ϵ��ѹǿ���ٷ����仯
B��v��(CO)=v��(H2O)
C������n mol CO��ͬʱ����n mol H2
D��1 mol H��H�����ѵ�ͬʱ����2 mol H��O��
(2)��������ѧƽ��״̬������Ӧ��ʼ�������ﵽƽ���ƽ����ϵ��ѹ(��С�ݻ���������������)���������������ƽ����Է��������� (��д�����䡱������С�����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��Һ�У���ӦA+2B C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ�Ⱦ�Ϊc(A)="0.100" mol/L��c(B )="0.200" mol/L��c(C )="0" mol/L����Ӧ��A��Ũ����ʱ��ı仯��ͼ��ʾ��
C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ�Ⱦ�Ϊc(A)="0.100" mol/L��c(B )="0.200" mol/L��c(C )="0" mol/L����Ӧ��A��Ũ����ʱ��ı仯��ͼ��ʾ��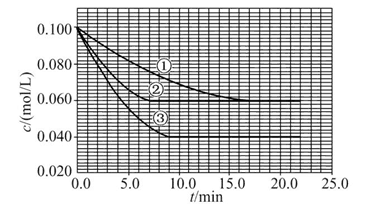
��ش��������⣺
(1)��ٱȽϣ��ں͢۷ֱ���ı�һ�ַ�Ӧ���������ı���������жϵ������ǣ��� ���� ��
(2)ʵ���ƽ��ʱB��ת����Ϊ ��ʵ���ƽ��ʱC��Ũ��Ϊ ��
(3)�÷�Ӧ�Ħ�H 0�����ж������� ��
(4)�÷�Ӧ���е�4.0 minʱ��ƽ����Ӧ���ʣ�ʵ��ڣ�v(B)= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(1)(�����߿�)����H2S������ȡ�����ķ����ж��֡�
�ٸ����ȷֽⷨ
��֪��H2S(g) H2(g)��
H2(g)��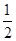 S2(g)
S2(g)
�ں����ܱ������У����Ʋ�ͬ�¶Ƚ���H2S�ֽ�ʵ�顣��H2S��ʼŨ�Ⱦ�Ϊc mol��L��1�ⶨH2S��ת���ʣ��������ͼ��ͼ��aΪH2S��ƽ��ת�������¶ȹ�ϵ���ߣ�b���߱�ʾ��ͬ�¶��·�Ӧ������ͬʱ����δ�ﵽ��ѧƽ��ʱH2S��ת���ʡ���ͼ����985 ��ʱH2S��������Ӧ�ֽ��ƽ�ⳣ��K��________��˵�����¶ȵ����ߣ�����b������a�ƽ���ԭ��__________________________��
(2)(���ϸ߿�)CuBr2�ֽ���Ȼ�ѧ����ʽΪ��
2CuBr2(s) 2CuBr(s)��Br2(g) ��H����105.4 kJ/mol
2CuBr(s)��Br2(g) ��H����105.4 kJ/mol
���ܱ������н�����CuBr2��487 K�¼��ȷֽ⣬ƽ��ʱp(Br2)Ϊ4.66��103 Pa��
���練Ӧ��ϵ��������䣬��߷�Ӧ�¶ȣ���p(Br2)����_______________(����������䡱��С��)��
���練Ӧ�¶Ȳ��䣬����Ӧ��ϵ���������һ������p(Br2)�ı仯��ΧΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1.0 L�ܱ������з���0.10 mol A(g)����һ���¶Ƚ������·�Ӧ��
A(g)??B(g)��C(g) ��H����85.1 kJ��mol��1
��H����85.1 kJ��mol��1
��Ӧʱ��(t)��������������ѹǿ(p)�����ݼ��±���
| ʱ��t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| ��ѹǿp/100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| ��Ӧʱ��t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol��L��1) | 0.10 | a | 0.026 | 0.006 5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij��������Ȼ����ˮ�����Ϳ���Ϊԭ�Ϻ���Դ�ϳɰ�����������ͼ��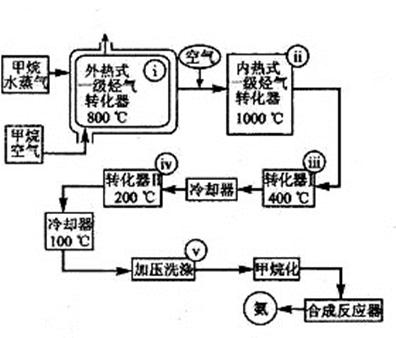
������������ʽһ����ת����ϵָ�� CH4Ϊȼ��������ת�����������ʹ֮ά�� 8000C���µĹ�ҵװ�á�����ʽһ������ת����ϵָ��H2��װ����ȼ��Ϊ����ά��һ������ת���������ɵ�CO��H2O(g)��Ӧ����CO2��H2����10000C���µ�װ�á��ڱ��Ϊi��v�ķ�Ӧ���з������·�Ӧ��
| A��CH4+2O2��CO2 +2H2O | B��CH4+H2O(g)��CO +3H2 |
| C��2CH4+3H2O(g)��CO + CO2 +7H2 | D��K2CO3+CO2 +H2O��2KHCO3 |
 CO2 + H2��H��0 F��2H2 +O2��2H2O
CO2 + H2��H��0 F��2H2 +O2��2H2O�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
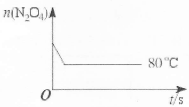
��80��ʱ����0.40mo1��N2O4�������2L�Ѿ���յĹ̶��ݻ����ܱ������У��������·�Ӧ��N2O4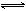 2NO2 ��H>0����һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
2NO2 ��H>0����һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
| t/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ���£�
| �� �ȣ��棩 | 360 | 440 | 520 |
| Kֵ | 0��036 | 0��010 | 0��0038 |
 CO(g) + 3H2(g) ��ȡ����֪�÷�Ӧ�У�����ʼ������е�
CO(g) + 3H2(g) ��ȡ����֪�÷�Ӧ�У�����ʼ������е� 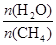 �㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ������ͼ��ʾ��
�㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ������ͼ��ʾ��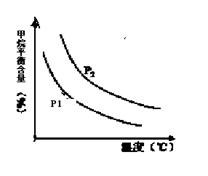
 CO2 (g) + H2(g) ��ȡ��
CO2 (g) + H2(g) ��ȡ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com