
| A. | CCl4和H2S | B. | H2O和NH3 | C. | CH4和CO2 | D. | H2O2和SO2 |
分析 根据由同种原子构成的共价键是非极性键,不同原子构成的共价键是极性键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子.
解答 解:A.CCl4中含有极性键,但结构对称,正负电荷的中心重合,属于非极性分子;H2S中含有极性键,空间结构为v形,正负电荷的中心不重合,属于极性分子,故A错误;
B.H2O中含有极性键,空间结构为V型,正负电荷的中心不重合,属于极性分子;NH3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,属于极性分子,故B正确;
C.CH4中含有极性键,但结构对称,正负电荷的中心重合,属于非极性分子;CO2中含有极性键,但结构对称,正负电荷的中心重合,属于非极性分子,故C错误;
D.H2O2中含有极性键和非极性键,但结构不对称,正负电荷的中心不重合,属于极性分子;SO2中含有极性键,但结构不对称,正负电荷的中心不重合,属于极性分子,故D错误.
故选B.
点评 本题考查化学键与分子的极性的关系,难度不大,注意非极性分子的结构对称,正负电荷中心重合来解答.


科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L KNO3溶液:、H+、Fe2+、Al3+、Cl- | |
| B. | 酸性溶液:NH4+、Fe2+、K+、SO42- | |
| C. | 碱性溶液:ClO-、SO32-、K+、Na+ | |
| D. | 与铝反应产生大量氢气的溶液:K+、Cl-、CO32-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-4 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与水反应时,生成2.24L氧气转移的电子数为0.2NA | |
| B. | 1L 0.1mol•L-1的NaHS溶液中HS-和S2-离子数之和为0.1NA | |
| C. | 标准状况下,2.24L三氯甲烷分子中含有共价键总数为0.4NA | |
| D. | 15g${\;}_{\;}^{14}{C}_{\;}^{16}O$和15g${\;}_{\;}^{12}{C}_{\;}^{18}O$中含有的中子数均为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
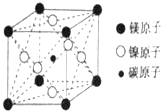 最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性.因这三种元素都是常见元素,从而引起广泛关注.该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为( )
最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性.因这三种元素都是常见元素,从而引起广泛关注.该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为( )| A. | MgCNi3 | B. | Mg2CNi3 | C. | MgCNi2 | D. | MgC2Ni |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向淀粉溶液中加入少量的稀硫酸,加热几分钟,冷却后再向该溶液中加入新制Cu(OH)2.没有红色沉淀生产,说明淀粉没有水解 | |
| B. | .向无水乙醇中加入浓H2SO4,加热至170℃,产生的气体通入酸性KMnO4溶液,紫红色褪去. 则使溶液褪色的气体是乙烯 | |
| C. | CO2通入到饱和的Na2CO3溶液中有晶体析出,则晶体为NaHCO3 | |
| D. | 检验Fe2+时,加入KSCN溶液后,发现溶液变红,则Fe2+已被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com