
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 石膏(CaSO4·2H2O)的生产流程示意图:
石膏(CaSO4·2H2O)的生产流程示意图: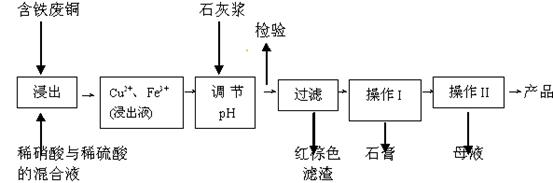
温度(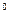 C) C) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
 C左右;
C左右;查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
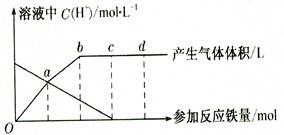
| A.若反应后有Cu剩余,则反应后溶液中含有的金属阳离子一定是Cu2+ |
| B.若反应后的溶液中有Cu2+,则反应后溶液中含有的金属阳离子一定是Fe2+、Fe3+ |
| C.若反应后的溶液中无金属剩余,则加入金属粉末质量8.4 g<a<9.6 g |
| D.若加入的Fe和Cu的质量比为7:8,则使HN03完全反应的金属粉末质量最小为7.2 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.可表示为3YO3·3FeO·Fe2O3 | B.可表示为Y3O5·Fe3O4·Fe2O3 |
| C.其中钇、铁的化合价均为+3价 | D.其中钇、铁的化合价均有+2、+3价 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.被还原的HNO。不可能是2a/3mol |
| B.溶液中剩余的n(NO3一)≤(0.4—2a/3)mol |
| C.溶液中不可能同时存在Fe2+、Fe3+、Cu2+ |
| D.当被还原的硝酸为0.8amol,则溶液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

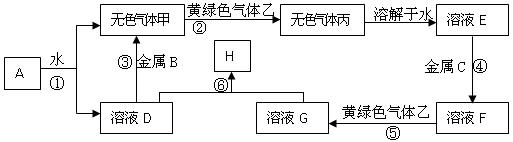
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com