
某同学将光亮的镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生。为探究该反应原理,该同学做了以下试验并观察到相关现象,由此得出的结论不合理的是:
| 选项 | 实验及现象 | 结论 |
| A | 将湿润的红色石蕊试纸放在试管口,试纸变蓝 | 反应中有NH3产生 |
| B | 收集产生的气体并点燃,火焰呈淡蓝色 | 反应中有H2产生 |
| C | 收集气体的同事测得溶液的pH为8.0 | 弱碱性溶液中Mg也可被氧化 |
| D | 将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生 | 弱碱性溶液中OH-氧化了Mg |
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:
氮化钠(Na3N)是科学家制备的一种重要化合物。它与水作用可生成NH3 和一种强碱。回答下列问题:
(1)氮化钠的电子式是 ,该化合物是 化合物(选填“离子”、“共价”)。
(2)氮化钠与水反应的化学方程式是 ,该反应属于 反应。
(3)氮化钠与盐酸反应生成 种盐,其中 (填盐的化学式)既含离子键又含有共价键。
(4)氮化钠中两种微粒的半径大小比较:r(Na+) r(N3-)(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下面是几种有机化合物的转换关系:
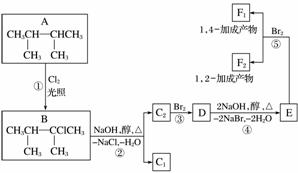
请回答下列问题:
(1)根据系统命名法,化合物A的名称是__________。
(2)上述框图中,①是__________反应,③是__________反应。(填反应类型)
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:________________________________________________________________________
________________________________________________________________________。
(4)C2的结构简式是__________________________________________________,
F1的结构简式是_______________________________________________________,
F1和F2互为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
合成导电高分子材料PPV的反应:
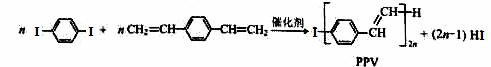
下列说法中正确的是
A.合成PPV的反应为加聚反应
B.PPV与聚苯乙烯具有相同的重复结构单元
C.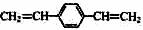 和苯乙烯互为同系物
和苯乙烯互为同系物
D.通过质谱法测定PPV的平均相对分子质量,可得其聚合度
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,其结构如下图。下列有关该物质的说法正确的是:
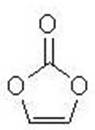
A.分子式为 C3H2O3
C3H2O3
B.分子中含6个σ键
C.分子中只有极性键
D.8.6g该物质完全燃烧得到6.72LCO2
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组将纯净的SO2气体通入0.1mol·L-1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组突出了如下假设:
假设 一:溶液中的NO3-
一:溶液中的NO3-
假设二:溶液中溶解的O2
(1) 验证假设
该小组涉及实验验证了假设一,请在下表空白处填写相关实验现象
| 实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 假设一成立 | |
| 实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 |
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线入下图
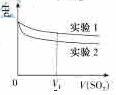
实验1中溶液pH变小的原因是____;V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示)_________。
(2) 验证假设二
请设计实验验证假设二,写出实验步骤,预期现象和结论。
| 实验步骤、预期现象和结论(不要求写具体操作过程) |
(3) 若假设二成立,请预测:在相同条件下,分别通入足量的O2和KNO3,氧化相同的H2SO3溶液(溶液体积变化忽略不计),充分反映后两溶液的pH前者_______(填大于或小于)后者,理由是
___________
查看答案和解析>>
科目:高中化学 来源: 题型:
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________________。
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
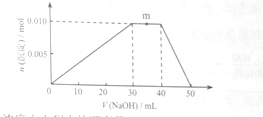
①R离子浓度由大到小的顺序是:__________。
②写出m点反应的而梨子方程式_________________。
③若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
碳素利用是环保科学家研究的热点课题。
I.某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g) CO2(g)+H2(g) △H<0,得到如下数据:
CO2(g)+H2(g) △H<0,得到如下数据:
| 实验组 | 温度/℃ | 起始量(mol) | 平衡量(mol) | 达到平衡所 需要时间/min | ||
| CO(g) | H2O(g) | CO2(g) | H2(g) | |||
| I | 800 | 2 | 2 | x | 1 | 5 |
| II | 900 | 1 | 2 | 0.5 | 0.5 | T1 |
| III | 900 | 2 | 2 | a | a | T2 |
(1)实验I中,前5min的反应速率υ(CO2)= 。
(2)下列能判断在800℃实验条件下CO(g)与H2O(g)反应一定达到平衡状态的是 。
A.容器内压强不再变化 B.n2(H2)= n(H2O)·n(CO)
C.混合气体密度不变 D.υ正(CO) =υ逆(CO2)
(3)实验II和III中CO的平衡转化率:αII(CO) αIII(CO) (填:>、<或=,下同) ,T1 T2,a= (填精确数值)。
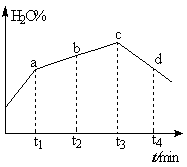 (4)若实验Ⅲ的容器改为在绝热的密闭容器中进行,实验测得H2O(g)的转化率随时间变化的示意图如下图所示, b点υ正 υ逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是 。
(4)若实验Ⅲ的容器改为在绝热的密闭容器中进行,实验测得H2O(g)的转化率随时间变化的示意图如下图所示, b点υ正 υ逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是 。
(5)CO和H2在一定条件下合成甲醇。
甲醇/空气碱性燃料电池中,
消耗32g甲醇,电池中有转移4.5 mol电子。
负极的电极反应式为 。
该电池中电流效率为 。
(电流效率η=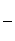 ×100%)
×100%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com