
对二甲苯(英文名称pxylene,缩写为PX)是化学工业的重要原料。
(1)写出PX的结构简式:______________。
(2)PX可发生的反应有________、________(填反应类型)。
(3)增塑剂(DEHP)存在如下图所示的转化关系,其中A是PX的一种同分异构体。
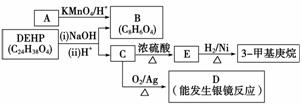
①B的苯环上存在2种不同化学环境的氢原子,则B的结构简式是__________________。
②D分子所含官能团是____________(填名称)。
③C分子有1个碳原子连接乙基和正丁基,DEHP的结构简式是__________________。
(4)F是B的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物;
b.遇FeCl3溶液显示特征颜色;
c.能与碳酸氢钠溶液反应。
写出F与NaHCO3溶液反应的化学方程式:________________________________________________________________________
________________________________________________________________________。
解析:(1)对二甲苯中两个甲基处于苯环的对位,结构简式为 。
。
(2)对二甲苯分子中甲基易被酸性高锰酸钾等氧化,故能发生氧化反应;该分子易与Cl2、Br2、浓HNO3等发生取代反应;由于含有苯环,故能与H2发生加成反应。
(3)①由于B是由A经氧化得到的,故为二元羧酸,当苯环上存在2种不同化学环境的氢原子时,B为邻苯二甲酸,其结构简式为 。②由于D能发生银镜反应,故分子中含有醛基。③由于C能被氧化成醛,则分子中含有—CH2OH,且有1个碳原子连接乙基和正丁基,则结构简式为
。②由于D能发生银镜反应,故分子中含有醛基。③由于C能被氧化成醛,则分子中含有—CH2OH,且有1个碳原子连接乙基和正丁基,则结构简式为 2,由B和C的结构简式可以推出DEHP的结构简式为
2,由B和C的结构简式可以推出DEHP的结构简式为
 。
。
(4)F遇FeCl3溶液有显色反应,故分子中含有酚羟基,能与碳酸氢钠溶液反应说明有羧基,又是苯的邻位二取代物,故分子结构为 。
。



 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如下:
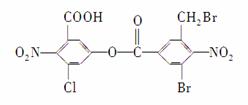
1 mol该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为( )
A.5 mol B.6 mol
C.7 mol D.8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
水杨酸最早取自柳树,其结构简式为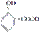 ,它的同分异构体很多,同时符合下列四个条件的同分异构体有多少种( )
,它的同分异构体很多,同时符合下列四个条件的同分异构体有多少种( )
①含有苯环 ②能发生银镜反应,不能发生水解反应 ③在稀NaOH溶液中1 mol该同分异构体能与2 mol NaOH发生反应 ④只能生成两种一氯代物
A.1 B.2 C.3 D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
贝诺酯是由阿斯匹林、扑热息痛经化学拼合制备的解热镇痛抗炎药,其合成反应式(反应条件略去)如下:
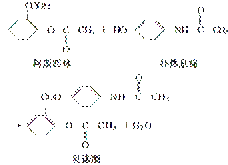
下列叙述错误的是( )
A.FeCl3溶液可区别阿斯匹林和扑热息痛
B.1 mol阿斯匹林最多可消耗2 mol NaOH
C.常温下贝诺酯在水中的溶解度小于扑热息痛
D.C6H7NO是扑热息痛发生类似酯水解反应的产物
查看答案和解析>>
科目:高中化学 来源: 题型:
C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍。该电池的电池反应式为:NaMO2 + nC  Na(1-x)MO2 + NaxCn ,下列有关该电池的说法正确的是( )
Na(1-x)MO2 + NaxCn ,下列有关该电池的说法正确的是( )
A、电池放电时,溶液中钠离子向负极移动
B、该电池负极的电极反应为:
NaMO2 — xe-  Na(1-x)MO2 + xNa+
Na(1-x)MO2 + xNa+
C、消耗相同质量金属时,用锂作负极产生电子的物质的量比用钠时少
D、电池充电时的阳极反应式为:nC + x Na+ - xe-  NaxCn
NaxCn
查看答案和解析>>
科目:高中化学 来源: 题型:
 ⑴右图是部分主族元素第一电离能梯度图,图中,a点对应的元素为氢,
⑴右图是部分主族元素第一电离能梯度图,图中,a点对应的元素为氢,
b、c两点对应的元素分别为 、 (填元素符号)。
⑵将CrCl3·6H2O溶解在适量水中得到深绿色溶液,溶液中Cr3+以
[Cr(H2O)5Cl]2+形式存在。
①上述溶液中,不存在的微粒间作用力是 (填标号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
②[Cr(H2O)5Cl]2+中Cr3+的轨道杂化方式不是sp3,理由是 。
 ⑶下面关于晶体的说法不正确的是________。
⑶下面关于晶体的说法不正确的是________。
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF> NaCl> NaBr>NaI
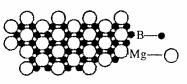
⑷硼化镁晶体在39K时呈超导性。在硼化镁晶体中,镁原子和硼原子是分层排布的,右图是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。则硼化镁的化学式为 。
⑸铁的金属密堆积方式为体心立方结构,结构如图所示。

则晶胞中铁原子的配位数为______。若铁原子的半径为r pm,写出该堆积方式的空间利用率的表达式(不要求算出结果)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
|
化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为:
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过____分离回收;滤渣的主要成分是MnO2、______和 ,欲从中得到较纯的MnO2,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲烷是正四面体结构,而不是正方形的平面结构,其理由是--------------------------( )
A.甲烷中的四个键的键长、键角相等 B .CH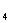 是分子晶体
是分子晶体
C.二氯甲烷只有一种结构 D .三氯甲烷只有一种结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com