
| A. | 新制生石灰 | B. | 新制氢氧化铜 | C. | 浓溴水 | D. | 银氨溶液 |
分析 四种有机物都易溶于水,其中乙醛含有-CHO,具有还原性,可用新制Cu(OH)2悬浊液检验,乙酸具有酸性,甲酸既具有酸性又具有还原性,以此选择鉴别试剂.
解答 解:A.新制生石灰与乙酸、甲酸都反应,没有明显的现象,与乙醇、乙醛都不反应,不能鉴别,故A错误;
B.加入新制Cu(OH)2悬浊液,乙醇不反应,乙醛在加热时生成砖红色沉淀,乙酸和氢氧化铜发生中和反应,氢氧化铜溶解,甲酸能溶解氢氧化铜,含有醛基,加热时有砖红色沉淀生成,可鉴别四种物质,故B正确;
C.加入溴水,不能鉴别乙醇、乙酸,故C错误;
D.银氨溶液不能鉴别乙醇、乙酸,不能鉴别乙醛和甲酸,故D错误.
故选B.
点评 本题考查有机物的鉴别,为高频考点,把握有机物性质的差异及反应中的不同现象为解答的关键,注意利用不同现象鉴别物质,注意甲酸中含-CHO、-COOH,题目难度不大.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | ①组物质都不能使酸性高锰酸钾褪色,②组物质都能使酸性高锰酸钾褪色 | |
| B. | ①组物质都不能使溴的四氯化碳褪色,②组物质都能使溴的四氯化碳褪色 | |
| C. | ②组物质所有原子可以在同一平面内 | |
| D. | 邻二甲苯的一氯代物只有两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
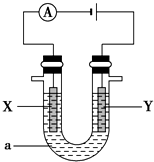
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径X>Y | B. | 氢化物稳定性H2X>HY | ||
| C. | 原子核内质子数R<M | D. | 溶液碱性ROH<MOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
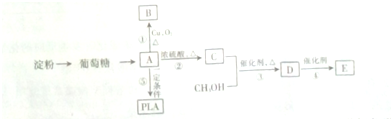
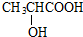 C中所含官能团的名称是羧基、碳碳双键
C中所含官能团的名称是羧基、碳碳双键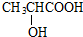 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$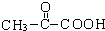 +2H2O反应④的化学方程式为n CH2=CHCOOCH3$\stackrel{催化剂}{→}$
+2H2O反应④的化学方程式为n CH2=CHCOOCH3$\stackrel{催化剂}{→}$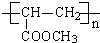
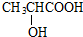 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ +(n-1)H2O
+(n-1)H2O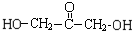 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持温度不变,缩小容器的体积,平衡向逆反应方向移动,再次达到平衡时气体的颜色变浅了 | |
| B. | 若保持恒温恒压,再充入一定量的NO2气体,当容器的体积不再变化时表明重新达到平衡状态 | |
| C. | 保持容器的体积不变,升高温度,正反应速率加快,逆反应速率减慢,平衡向正反应方向移动 | |
| D. | 恒温恒容条件下,再充入一定量的N2O4,达到新平衡时NO2的体积分数比原平衡的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
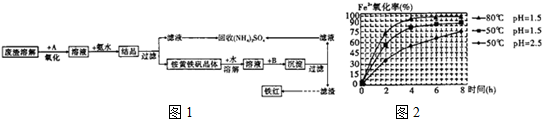 -
-查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子半径大小呈周期性变化 | |
| B. | 元素原子最外层电子排布呈周期性变化 | |
| C. | 元素原子量依次递增 | |
| D. | 元素的最高正化合价呈周期性变化同温同压下 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com