
 一定条件下,在容积为1L的密闭容器中发生可逆反应:Fe(s)+H2O(g)═FeO(s)+H2(g)△H>0.在1000℃时,H2O(g)的平衡转化率(α)与体系总压强(p)关系如图所示.
一定条件下,在容积为1L的密闭容器中发生可逆反应:Fe(s)+H2O(g)═FeO(s)+H2(g)△H>0.在1000℃时,H2O(g)的平衡转化率(α)与体系总压强(p)关系如图所示.| c(H2) |
| c(H2O) |
| c(H2) |
| c(H2O) |
| n(H2O) |
| V |
| 1.00mol |
| 1L |


科目:高中化学 来源: 题型:

| A、其分子式为C27H30O3,与银氨溶液发生银镜反应 |
| B、1 mol该物质与NaOH溶液反应,最多消耗2 mol |
| C、既能发生加聚反应,又能发生缩聚反应 |
| D、既可以使溴的四氯化碳溶液褪色,又可以使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(K+) | ||
n(
|
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、R为前四周期元素且原子序数依次增大.X的单质与氢气可以化合生成气体G,其水溶液 pH>7;Y单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍.Z与钠元素形成的化合物Q的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M.
X、Y、Z、R为前四周期元素且原子序数依次增大.X的单质与氢气可以化合生成气体G,其水溶液 pH>7;Y单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍.Z与钠元素形成的化合物Q的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
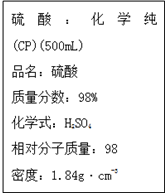 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种元素所形成的酸的酸性:H3XO4>H3YO4 |
| B、两种元素所形成的气态氢化物的稳定性:XH3>YH3 |
| C、两种元素所形成的最高价氧化物的稳定性:X2O5>Y2O5 |
| D、两种元素所形成的气态氢化物的还原性:YH3>XH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com