(2013?江苏三模)硅藻土是由硅藻死亡后的遗骸沉积形成的,主要成分是 SiO
2和有机质,并含有少量的Al
2O
3、Fe
2O
3、MgO 等杂质.精制硅藻土因为吸附性强、化学性质稳定等特点被广泛应用.下图是生产精制硅藻土并获得Al(OH)
3的工艺流程.
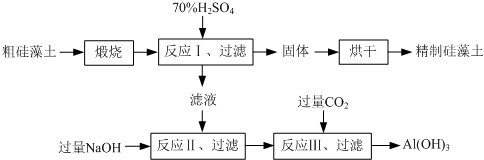
(1)粗硅藻土高温煅烧的目的是
除去有机质
除去有机质
.
(2)反应Ⅲ中生成Al(OH)
3沉淀的化学方程式是
NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
;氢氧化铝常用作阻燃剂,其原因是
氢氧化铝分解吸收热量,且生成高熔点的氧化铝覆盖在表面
氢氧化铝分解吸收热量,且生成高熔点的氧化铝覆盖在表面
.
(3)实验室用酸碱滴定法测定硅藻土中硅含量的步骤如下:
步骤1:准确称取样品a g,加入适量KOH固体,在高温下充分灼烧,冷却,加水溶解.
步骤2:将所得溶液完全转移至塑料烧杯中,加入硝酸至强酸性,得硅酸浊液.
步骤3:向硅酸浊液中加入NH
4F溶液、饱和KCl溶液,得K
2SiF
6沉淀,用塑料漏斗过滤并洗涤.
步骤4:将K
2SiF
6转移至另一烧杯中,加入一定量蒸馏水,采用70℃水浴加热使其充分水解(K
2SiF
6+3H
2O═H
2SiO
3+4HF+2KF).
步骤5:向上述水解液中加入数滴酚酞,趁热用浓度为c mol?L
-1NaOH的标准溶液滴定至终点,消耗NaOH标准溶液VmL.
①步骤1中高温灼烧实验所需的仪器除三角架、泥三角、酒精喷灯外还有
d
d
.
a.蒸发皿 b.表面皿 c.瓷坩埚 d.铁坩埚
②实验中使用塑料烧杯和塑料漏斗的原因是
实验中产生的HF能与玻璃仪器中的SiO2等物质反应
实验中产生的HF能与玻璃仪器中的SiO2等物质反应
.
③步骤3中采用饱和KCl溶液洗涤沉淀,其目的是
洗去沉淀表面的HF等杂质;增大K+浓度,减少K2SiF6的损失
洗去沉淀表面的HF等杂质;增大K+浓度,减少K2SiF6的损失
.
④步骤4中滴定终点的现象为
最后一滴滴入后溶液由无色变为粉红色,且30s不褪色
最后一滴滴入后溶液由无色变为粉红色,且30s不褪色
.
⑤样品中SiO
2的质量分数可用公式“w(SiO
2)=
×100%”进行计算.由此分析步骤5中滴定反应的离子方程式为
HF+OH-=F-+H2O
HF+OH-=F-+H2O
.

 阅读快车系列答案
阅读快车系列答案