
对常温下pH=3的CH3COOH溶液,下列叙述不正确的是
A.c(H+)=c(CHCOO-)+c(OH-)
B.加入少量CH3COONa固体后,加入,c(CH3COO-)降低
C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L
D.与等体积pH =11的NaOH溶液混合后所得溶液显酸性
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:简答题
【化学与技术】
下图表示某些化工生产的流程(有的反应条件和产物已略去)

请回答下列问题:
(1)流程中所涉及的化学工业 (写出两个即可)。
(2)反应I需在500℃进行,主要原因是 ;实际工业生产中,反应Ⅱ的条件是 。
(3)写出反应III的化学方程式 。
(4)工业上,析出K后,再向母液中继续通入E,并加入细小食盐颗料,其目的是 。
(5)工业上常用Na2CO3溶液吸收制取HNO3产生的尾气中的NO2,生成NaNO3、NaNO2和一种气体,写出反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:简答题
硫酸工业在国民经济中占有极其重要的地位。请回答硫酸工业中的如下问题:
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在 郊
区(填标号);
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市 D.人口稠密的文化、商业中心城市
(2)CuFeS2 是黄铁矿的另一成分,煅烧时CuFeS2 转化为CuO、Fe2O3和SO2,
该反应的化学方程式为 。
(3)为提高SO3吸收率,实际生产中通常用 吸收SO3。
(4)已知反应2SO2+O2 SO3 △H <0,现将0.050mol SO2和0.030mol O2
SO3 △H <0,现将0.050mol SO2和0.030mol O2
充入容积为1L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压
强缩小到原来压强的75%,则该条件下SO2的转化率为________;该条件下的
平衡常数为__________。
(5)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3 在
沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
已知CuSO4 在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随
温度升高而降低的原因 。
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方
法可用 (填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产
水泥的辅料,写出这两步反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:简答题
在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用。下图是生产亚氯酸钠的工艺流程图:
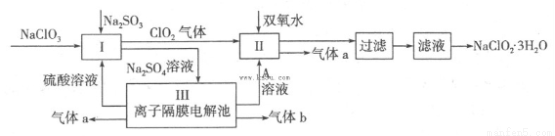
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出
NaClO2·3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4 ×10-28
(1)反应I中发生反应的离子方程式为 。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是 (填写序号)。
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
弱酸 | HClO2 | HF | H2CO3 | H2S |
Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaHCO3、Na2S四种溶液的pH由大到小的顺序为 (用化学式表示);体积相等,物质的量浓度相同的NaF、NaClO2两溶液中所含阴阳离子总数的大小关系为: (填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是 ;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为 。
(4)Ⅲ装置中生成气体a的电极反应式 ,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:选择题
下列说法正确的是
A.1L 1mol?L-1的NH4Cl溶液中一定含有NA个NH4+
B.常温常压下,22.4L乙烯中含共价键数为5 NA
C.6.8g熔融的KHSO4中含有0.05 NA个阳离子
D.1mol冰醋酸和lmo1乙醇在浓硫酸加热下反应可生成NA个H2O
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:选择题
设计如下装置探究HCl溶液中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu)。恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa'处形成清晰的界面。通电后,可观察到清晰界面缓缓向上移动。下列说法不正确的是

A.通电后,可观察到清晰界面缓缓向上移动的原因是Cd2+向Pt电极迁移的结果
B.装置中Pt电极附近的pH增大
C.一定时间内,如果通过HCl溶液某一界面的总电量为5.0 C,测得H+所迁移的电量为4.1 C,说明该HCl溶液中H+的迁移速率约是Cl-的4.6倍
D.如果电源正负极反接,则下端产生大量Cl2,使界面不再清晰,实验失败
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:简答题
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: 
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入过量废铁屑的目的是 ;加入少量NaHCO3的目的是调节pH,使溶液中的
(填“Fe3+”“Fe2+”或“Al3+”)沉淀,该工艺中“搅拌”的作用是 。
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 ,若参与反应的O2有11.2L(标准状况),则相当(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成
Fe2(OH)42+ 聚合离子.该水解反应的离子方程式为 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-,为检验所得产品中是否含有Fe2+,应使用的试剂为 。(填字母)。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测2 题型:实验题
如图是一个制取氯气并以氯气为原料进行特定反应的装置。
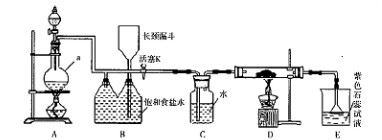
(l)A是氯气发生装置,写出其中的化学反应方程式 。
(2)a仪器的名称为 。
(3)实验开始时,先点燃A处的酒精灯,打开活塞K,让 氯气充满整个装置,再点燃D处酒精灯,连接上E装置。D装置的硬质玻璃管内盛有炭粉,反应产物为CO2和HC1。写出D中反应的化学方程式 ,装置C的作用是 。
氯气充满整个装置,再点燃D处酒精灯,连接上E装置。D装置的硬质玻璃管内盛有炭粉,反应产物为CO2和HC1。写出D中反应的化学方程式 ,装置C的作用是 。
(4)在E处,若漏斗内气体带有黄绿色,则紫色石蕊试液的颜色变化为 。
(5)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为 (填序号)。
①有白色沉淀生成;②无白色沉淀生成;③先生成白色沉淀,而后白色沉淀消失。
(6)D处反应完毕后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有Cl2
产生,则装置B中的现象是 ;若发现装置B中该现象不明显,可能的
原因是 ;查找原因时可用肥皂水或湿润的碘化钾淀粉试纸等,若用蘸
有浓氨水的玻璃棒检查时观察到有白烟产生,写出该氧化还原反应的化学方程
式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:选择题
在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是

A.按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-===Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O===4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com