
【题目】下列各组离子在选项条件下一定能大量共存的是
A. 无色溶液:Na+、Fe2+、Cl-、 SO42-
B. 酸性溶液:NH4+、 Fe3+、I-、SO42-
C. 碱性溶液:K+、Mg2+、SO42-、NO3-
D. 遇酚酞变红的溶液:Na+、K+、SO42-、Cl-
科目:高中化学 来源: 题型:
【题目】NO2是大气污染物之一,实验室拟用NO2与Cl2混合用NaOH溶液吸收的方法消除其污染.回答下列问题:
(1)氯气的制备 
①仪器M、N的名称依次是 .
②欲用MnO2和浓盐酸制备并收集一瓶纯净干燥的氯气,选呢图1中的装置,其连接顺序为(按气流方向,用小写字母表示).
③D在制备装置中的作用是;用离子方程式表示装置F的作用是 .
(2)用如图2所示装置探究Cl2和NO2在NaOH溶液中的反应. 查阅有关资料可知:HNO3是一种弱酸,且不稳定,易分解生成NO和NO2 .
①装置中X和Z的作用是
②实验时观察到X试剂瓶中有黄绿色气体,Z试剂瓶中有红棕色气体,若通入适当比例的Cl2和NO2 , Y中观察不到气体颜色,反应结束后加入稀硫酸无现象,则Y中发生反应的化学方程式是 .
③反应结束后,取Y中溶液少许于试管中,加入稀硫酸,若有红棕色气体产生,解释产生该现象的原因: . 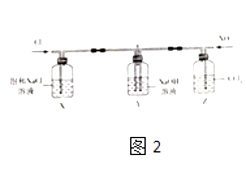
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向BaCl2溶液中通入SO2将溶液分置于两支试管中,向一份中加入NaOH溶液,出现白色沉淀A,另一份通入少量Cl2,产生白色沉淀B,试回答下列问题:
(1)若不考虑SO2与水的反应向BaCl2溶液中通入SO2无明显现象,“无明显现象”可能是“不反应”,也可能是“反应但无现象”.此处应为 ,原因是 .
(2)沉淀A的化学式为 ,该沉淀能否溶于稀盐酸? _.
(3)写出生成沉淀B的离子方程式: .
(4)生成2.33 g沉淀B,需消耗标准状况下的Cl2 mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入 铜粉,最多能溶19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁 粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果不正确的是( )

A. 图中,AB段的反应为Fe+2Fe3+===3Fe2+,溶液中溶质最终为硫酸亚铁
B. 原溶液中硫酸浓度为2.5 mol·L-1
C. 原混合溶液中硝酸根离子的物质的量为0.4 mol
D. 图中,OA段产生的气体是一氧化氮,BC段产生的气体是氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠常用作食品防腐剂.现用如图所示仪器(夹持装置已省略)及药品.探究亚硝酸钠与硫酸的反应及生成气体产物的成分.已知气体液化的温度:NO2:21℃;﹣152℃ 
回答下列问题:
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(按从左到右连接):A→C→→→ .
(2)组装好仪器后,接下来进行的操作是;实验开始时通入N2的作用是 .
(3)关闭弹赞夹K1 , 打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体.确认A中产生的气体中含有NO,依据的现象是;装置E的作用是 .
(4)根据上述实验,写出该反应的化学方程式: . 如果没有装置C,对验证结论造成的影响是 .
(5)实验结柬后还需通入N2的作用是;如果向D中通入过量O2 , 则装置B中发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和硫及其化合物的转化是资源利用和环境保护的重要研究课题.
(1)已知反应I:2SO2(g)+O2(g)2SO3(g),△H=﹣196.6KJmol﹣1反应II:2NO(g)+O2(g)2NO2(g),△H=﹣113.0KJmol﹣1
则SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热反应方程式为 .
(2)①若在绝热恒容密闭容器中通入一定量的SO2和O2 , 一定条件下发生反应I,一段时间内,正反应速率随时间变化曲线如图所示,则在a点时,反应(填“达到”或“未达到”)平衡状态;t1~t3时间内,v正先增大后减小的主要原因是 . ②若在两个相同绝热恒容密闭容器中分别加入A:2molSO2(g)和1molO2(g);B:2molSO3(g),其它条件相同,发生反应I,达到平衡时,则该反应的平衡常数:AB(填“>”、“=”、“<”).
(3)已知常温下,H2S的电离常数:K1=1.3×10﹣7 , K2=7.1×10﹣15 , Ksp(H2S)=4×10﹣53 , Ksp(Ag2S)=6.3×10﹣50 , Ksp(HgS)=1.6×10﹣52 , 则0.1mol/L H2S溶液的pH约为(取近似整数值);向浓度均为0.001moll﹣1的AgNO3和Hg(NO3)2混合溶液中通入H2S气体,开始生成沉淀的c(S2﹣)为 .
(4)NH3催化还原氮氧物技术(SCR)是目前应用广泛的烟气氮氧化物脱除技术.现有NO、NO2的混合气6L,可用同温同压下7L的NH3恰好使其完全转化为N2 , 则原混合气体中NO和NO2的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、NO和H2O,当NO2与NO的物质的量之比为6:1时,实际参加反应的FeS与HNO3的物质的量之比为
A. 2:11 B. 1:6
C. 1:7 D. 1:8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于纸色谱法分离Fe3+和Cu2+操作正确的是( )
A.裁滤纸应垂直纤维方向裁开
B.点样时,斑点尽量小,且再点时必须在同一位置
C.展开时,用流动相溶剂刚好淹过色斑进行展开
D.当流动相溶剂上升至滤纸上沿时,取出晾干观察
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com