

分析 (1)C是漏斗、D是容量瓶;
(2)E是分液漏斗,用于分离互不相溶的液体;
(3)①氯气和NaOH反应生成NaCl、NaClO和水;
②根据方程式Cl2+2NaOH=NaCl+NaClO+H2O知,氯气和NaOH以1:2反应;
③m(NaOH)=CVM,配制一定物质的量浓度溶液需要烧杯、胶头滴管、容量瓶;
根据C=$\frac{n}{V}$知,如果n偏小或V偏大都导致C偏低.
解答 解:(1)C是漏斗、D是容量瓶,故答案为:漏斗;容量瓶;
(2)E是分液漏斗,用于分离互不相溶的液体,
a.水和CCl4不互溶,二者混合分层,应该采用分液方法分离,使用的仪器是分液漏斗,故正确;
b.水和酒精互溶,二者应该根据熔沸点不同采用蒸馏方法分离,故错误;
c.分离水和泥砂的混合物应该采用过滤方法分离,故错误;
故选a;
(3)①氯气和NaOH反应生成NaCl、NaClO和水,反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
②根据方程式Cl2+2NaOH=NaCl+NaClO+H2O知,氯气和NaOH以1:2反应,n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,根据方程式知,0.1mol氯气完全反应需要0.2molNaOH,V(NaOH)=$\frac{0.2mol}{0.5mol/L}$=0.4L,故答案为:0.4;
③m(NaOH)=CVM=0.5mol/L×0.25L×40g/mol=5.0g,配制一定物质的量浓度溶液需要烧杯、胶头滴管、容量瓶,还可以用量筒量取水;
A.用滤纸称量氢氧化钠固体,NaOH吸水,导致n偏小,则配制溶液浓度偏低,故正确;
B.溶解搅拌时有部分液体溅出,导致n偏小,则配制溶液浓度偏低,故正确;
C.溶解时未冷却至室温,导致V偏小,配制溶液浓度偏高,故错误;
D.加水至刻度线后摇匀,发现液面低于刻度线,n、V都不变,则配制溶液浓度不变,故错误;
E.在定容时,仰视刻度线,V偏大,导致C偏低,故正确;
F.洗涤容量瓶后,未干燥,瓶中有少量蒸馏水,n、V都不变,则配制溶液浓度不变,故错误;
故答案为:5.0g;ABD(F);ABE.
点评 本题考查一定物质的量浓度溶液配制、物质分离和提纯,侧重考查基本理论,会根据物质的性质确定分离方法,易错点是配制溶液误差分析,注意容量瓶中含有少量蒸馏水不影响配制溶液浓度.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氮分子的电子式 N:::N | B. | 镁原子的原子结构示意图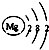 | ||
| C. | 质量数是16的氧原子 ${\;}_{8}^{16}O$ | D. | 乙醇的结构简式 C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
 H2O(l)═H+ (aq)+OH- (aq)△H=b kJ/mol
H2O(l)═H+ (aq)+OH- (aq)△H=b kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:解答题
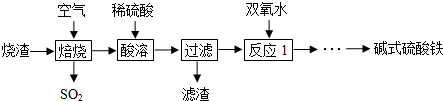
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | Fe2+ | Fe3+ | Cu2+ |
| 开始沉淀时的pH(初始浓度为1.0mol/L) | 6.5 | 1.5 | 4.2 |
| 沉淀完全时的pH | 9.7 | 3.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4分子的比例模型: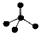 | B. | 氯原子的结构示意图: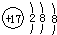 | ||
| C. | 乙烯的结构简式 CH2CH2 | D. | CS2结构式:S=C=S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+HNO3(浓)→Cu(NO3)2 | B. | Cu+HNO3 (稀)→Cu(NO3)2 | ||
| C. | Cu→CuO→Cu(NO3)2 | D. | Cu→CuSO4→Cu(NO3)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com