
| 相关信息 | |
| A | 所处的周期数、族序数分别与其原子序数相等 |
| B | 核外有3种不同原子轨道,每个轨道容纳的电子数相等 |
| C | 基态时,2p轨道处于半充满状态 |
| D | 与C元素处于同一周期,且D的第一电离能小于C的第一电离能 |
| E | 是目前生产、生活中应用最广泛的金属 |

 .
.分析 A、B、C、D、E五种前四周期的元素,原子序数依次增大,A元素所处的周期数、族序数分别与其原子序数相等,则A为H元素;核外有3种不同原子轨道,每个轨道容纳的电子数相等,核外电子排布为1s22s22p2,故B为碳元素;基态时,C元素原子2p轨道处于半充满状态,核外电子排布为1s22s22p3,故C为N元素;D与C元素处于同一周期,且D的第一电离能小于C的第一电离能,原子序数大于氮,则D为O元素;E是目前生产、生活中应用最广泛的金属,则E为Fe,据此解答.
解答 解:A、B、C、D、E五种前四周期的元素,原子序数依次增大,A元素所处的周期数、族序数分别与其原子序数相等,则A为H元素;核外有3种不同原子轨道,每个轨道容纳的电子数相等,核外电子排布为1s22s22p2,故B为碳元素;基态时,C元素原子2p轨道处于半充满状态,核外电子排布为1s22s22p3,故C为N元素;D与C元素处于同一周期,且D的第一电离能小于C的第一电离能,原子序数大于氮,则D为O元素;E是目前生产、生活中应用最广泛的金属,则E为Fe.
(1)E为Fe元素,位于元素周期表第四周期第Ⅷ族,其简化电子排布式为[Ar]3d64s2,
故答案为:四、Ⅷ;[Ar]3d64s2;
(2)D为O元素,原子最外层电子排布图是: ,
,
故答案为: ;
;
(3)H和C按照 1:1组成的相对分子质量最小的化合物甲为C2H2,
①甲的结构式为H-C≡C-H,每个甲分子中含有3个σ键,故答案为:3;
②原电池负极发生氧化反应,乙炔在负极失去电子,碱性条件下生成碳酸根与水,负极电极反应式为:C2H2-10e-+14OH-=2CO32-+8H2O,
故答案为:C2H2-10e-+14OH-=2CO32-+8H2O;
(4)A和C组成的固体化合物AC5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,该化合物为NH4H,电子式为 ,故答案为:
,故答案为: ;
;
(5)BeCl2与AlCl3的性质相似,向BeCl2溶液中加入过量的NaOH溶液反应的化学方程式:BeCl2+4NaOH═Na2BeO2+2NaCl+2H2O,
故答案为:BeCl2+4NaOH═Na2BeO2+2NaCl+2H2O.
点评 本题考查结构性质位置关系应用,侧重对化学用语及知识迁移运用能力考查,难度中等.


科目:高中化学 来源: 题型:选择题
 二甲醚汽车发动机具有显著的节能减排效果,其核心为燃料电池,该电池工作的原理示意图如图所示.下列有关说法错误的是( )
二甲醚汽车发动机具有显著的节能减排效果,其核心为燃料电池,该电池工作的原理示意图如图所示.下列有关说法错误的是( )| A. | 负极上的电极反应式CH3OCH3-12e-+3H2O═2CO2+12H+ | |
| B. | 工作过程中,H+移向正极 | |
| C. | 每消耗0.5molO2就有2mole-通过离子交换膜 | |
| D. | 电池总反应为2C2H6O═4CO2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
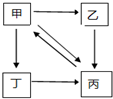 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| 甲 | 乙 | 丙 | 丁 | |
| A | Cu | CuCl2 | CuO | Cu(NO3)2 |
| B | Na2CO3 | NaOH | NaHCO3 | CO2 |
| C | Fe | FeCl3 | Fe(OH)3 | Fe2O3 |
| D | Al2O3 | Al(OH)3 | NaAlO2 | AlCl3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
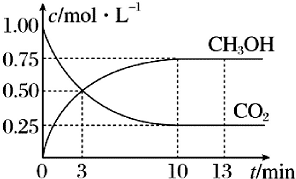 已知:CO2(g)+3H2(g)?CH5OH(g)+H2O(g)△H=-49.0kJ•mol-1一定条件下,向体积为1L的恒容密闭容器中充入1mol CO2和3mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图所示,下列叙述中正确的是( )
已知:CO2(g)+3H2(g)?CH5OH(g)+H2O(g)△H=-49.0kJ•mol-1一定条件下,向体积为1L的恒容密闭容器中充入1mol CO2和3mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图所示,下列叙述中正确的是( )| A. | 3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 | |
| B. | 从反应开始到平衡,H2的平均反应速率v(H2)=0.225mol•L-1•min-1 | |
| C. | 13min时,向容器中充入2mol氦气,该反应的化学反应速率增大 | |
| D. | 13min时,向容器中充入2mol CO2,该反应化学平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8g的NH4+离子中含有的电子数0.1NA | |
| B. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA个电子 | |
| C. | 1 mol Al分别放入足量的冷的浓HNO3、稀HNO3中,反应后转移电子均为3NA | |
| D. | 标准状况下,11.2LH2O中含有的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 都能与溴水反应,原因不完全相同 | |
| B. | 遇FeCl3溶液都显色,原因相同 | |
| C. | 都不能发生消去反应,原因相同 | |
| D. | 都能与NaOH溶液反应,原因不完全相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com