
| A. | 该反应涉及到了共价键和离子键的断裂和形成 | |
| B. | 反应物所具有的总能量高于产物所具有的总能量 | |
| C. | 断开1molH-H键和1mol Cl-Cl键,所吸收的总能量,小于形成1molH-Cl键,所放出的能量 | |
| D. | 该反应中,热能转变为化学能 |
分析 A.根据H2、Cl2、HCl都是由非金属元素之间形成,而非金属元素之间易形成共价键(铵盐除外)判断;
B.放热反应反应物所具有的总能量高于产物所具有的总能量;
C.放热反应的本质是生成物成键释放的总能量大于反应物断键吸收的总能量;
D.放热反应中化学能转变为热能、光能等.
解答 解:A.因为H2、Cl2、HCl都是由非金属元素之间形成,则该反应只涉及到了共价键的断裂与形成,没有离子键的断裂与形成,故A错误;
B.H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl是放热反应,所以反应物所具有的总能量高于产物所具有的总能量,故B正确;
C.H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl是放热反应,断开1mol H-H键和1mol Cl-Cl键,所吸收的总能量,小于形成2mol H-Cl键,所放出的能量,故C错误;
D.放热反应中化学能转变为热能、光能等,故D错误.
故选B.
点评 本题主要考查了化学反应的本质以及能量变化的宏观和微观原因,难度不大,注意基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | Y,Z形成的分子空间构型可能是正四面体 | |
| B. | W,Y,Z的电负性大小顺序一定是Z>Y>W | |
| C. | WY2分子中δ键与π键的数目之比是2:1 | |
| D. | W,X,Y,Z的原子半径大小顺序可能是W>X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2、D2、T2三者互为同素异形体 | |
| B. | NH4Cl的电子式为: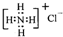 | |
| C. | 放射性同位素${\;}_{67}^{166}$Ho的原子核内的中子数与核外电子数之差是32 | |
| D. | 聚丙烯的结构简式为: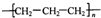 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的化学反应不一定是吸热反应 | |
| B. | 化学键断裂放出能量 | |
| C. | 燃料电池的负极发生还原反应 | |
| D. | 氢氧化钡晶体与氯化铵的反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
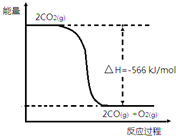 已知:①2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
已知:①2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1| A. | CO的燃烧热为566kJ•mol-1 | |
| B. | 如图可表示①反应过程中的能量变化 | |
| C. | Na2O2(s)+CO(g)═Na2CO3(s)△H=-509kJ•mol-1 | |
| D. | 由②可知,反应生成Na2CO3固体106g,放出热量226kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.
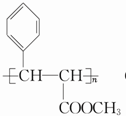 .
. .
. 和
和 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜及其化合物在工农业生产和日常生活中有着广泛的用途.请回答下列问题:
铜及其化合物在工农业生产和日常生活中有着广泛的用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 没有将洗涤液转移到容量瓶中 | B. | 容量瓶洗净后未经干燥处理 | ||
| C. | 转移过程中有少量的溶液溅出 | D. | 定容时俯视容量瓶刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、K+、SO42-、Cl-、AlO2- | B. | Fe2+、H+、Br-、NO3-、Cl- | ||
| C. | Na+、K+、SO42-、NO3-、Cl- | D. | Al3+、Na+、Cl-、SO42-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com