
(15分)
三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如下图所示。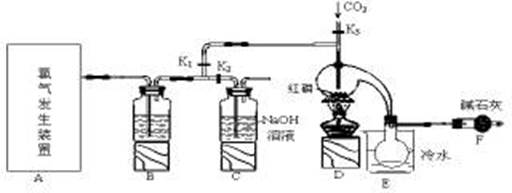
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见下表。
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(除标注外,每空2分,共15分)
(1) MnO2 + 4H+ + 2Cl—△ Mn2+ + Cl2↑+ 2H2O (其他合理答案均计分)
(2) 浓硫酸 冷凝,便于收集产品 (合理答案均计分)
(3) 玻璃管口用水润湿(合理答案均计分)
(4) 排尽曲颈瓶中的空气,防止PCl3与O2等发生副反应(合理答案均计分)
(5) 蒸馏
(6) 0.15 (1分) 0.15mol < n < 0.25mol (无单位此次不扣分)
解析试题分析:(1)A装置是产生氯气的装置,二氧化锰与浓盐酸加热制取氯气,离子方程式为 MnO2 + 4H+ + 2Cl—△ Mn2+ + Cl2↑+ 2H2O ,或者用高锰酸钾溶液与浓盐酸不加热制取氯气;
(2)实验室常用红磷与干燥的Cl2制取PCl3,所以氯气需干燥后通入C中,B中盛放浓硫酸;PCl3的熔点较低,所以E中烧杯内冷水的作用是 冷凝,便于收集产品 ;
(3)玻璃管与橡胶管连接时,往往把胶管的一端用水浸湿,或把玻璃管口用水润湿,方便连接;
(4)因为PCl3遇O2会生成POCl3,所以装置内不能存在氧气,所以通入干燥CO2的目的排尽曲颈瓶中的空气,防止PCl3与O2等发生副反应生成POCl3;
(5)由信息可知,POCl3与PCl3都是液体,沸点相差较大,故可以用蒸馏的方法进行分离;
(6)300ml 1mol/L的NaOH溶液中Na元素的物质的量是0.3mol,根据元素守恒,生成的NaCl 、 NaClO 和 NaClO3等钠盐的总物质的量为0.3mol,所以需要氯气0.15mol;若只生成NaCl 、 NaClO ,则转移的电子最少为0.15mol×2×1/2=0.15mol,若只生成NaCl 、 NaClO3,则转移的电子最多,根据得失电子守恒,NaCl 、 NaClO3的物质的量之比是5:1,所以转移电子的物质的量为0.15mol×2×5/6=0.25mol,当三种产物都存在时转移电子的物质的量介于二者之间 0.15mol < n < 0.25mol 。
考点:考查物质制备实验,装置的判断,理解题目所给信息的能力,氧化还原反应的计算


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:填空题
琉酸是无机“三大强酸"之一,其产量是衡量一个国家无机化工发展水平的重要标志。工业制硫酸的工艺流程如下图:
据图回答下列问题:
(1)写出用黄铁矿(主要含FeS2)造气的化学反应方程式________。
(2) 给出A、B物质的名称:A________,B________
(3) 催化氧化之前对SO2和空气的混合气体进行净化、干燥的目的是________ 选用B进入吸收塔吸收SO3的优点是________。
(4) SO2的催化氧化是一个可逆反应,采取适宜的反应条件有利于生产的进行。实际生产中,下列哪些生产条件或措施考虑到了平衡移动原理________ (选填序号)。
A.矿石加入沸腾炉之前先粉碎
B.使用V2O5作催化剂
C.催化反应室中选择400-5000C温度
D.净化后的炉气中要有过量的空气
E. 催化氧化在常压下进行
F. 将尾气中的SO2循环利用
(5) 某硫酸厂每天消耗黄铁矿石(含FeS2质量分動60%) 20吨,生产的三阶段的转化率依次为98%、95%、98%,则该工厂一天能生产B的质量为__________吨。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室可以用如下方法制取少量单质溴:
2NaBr+MnO2+2H2SO4 Na2SO4+MnSO4+Br2↑+2H2O
Na2SO4+MnSO4+Br2↑+2H2O
根据左图实验装置,填空和回答问题: 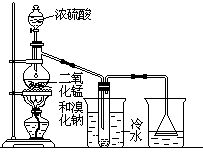
(1)装置(Ⅰ)的烧杯中冷水所起的作用是______ ,装置(Ⅱ)的烧杯中液体的作用是 ______________。
(2)进行此实验时,烧瓶内的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,这是因为 ____________________________。
(3)装置(Ⅱ)烧杯中使用倒置漏斗可防止液体倒吸,试简述其原因
________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(本题16分)Ⅰ。某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验。
【实验1】铜与浓硫酸反应,实验装置如图所示。
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为 。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是 。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是 。
Ⅱ。饱和的NaHSO3溶液可以与醛发生加成反应,生成水溶性的α-羟基磺酸钠。发生的反应为:
R-CHO + NaHSO3 R-CH(OH)SO3Na
R-CH(OH)SO3Na
反应是可逆的,在通常条件下有70%--90%向正反应方向转化。
(4)利用Ⅰ中装置制取少量NaHSO3溶液,应采取措施,将装置进行部分改变。这种措施是:_____________________________________________________________________;确认有NaHSO3生成的现象是:_______________________________________.
(5)若溴苯中混有杂质乙醛,欲将此杂质除去,可采用的试剂是:__________,其分离的方法是:_____________________.
(6)若在CH3-CH(OH)SO3Na 水溶液中加入足量盐酸,有机物转化为:___________,将该转化产物分离出来的方法常用__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)利用下图装置进行木炭粉和浓硫酸的反应及其产物的检验。
已知:紫红色的酸性高锰酸钾溶液能与二氧化硫发生氧化还原反应,向酸性高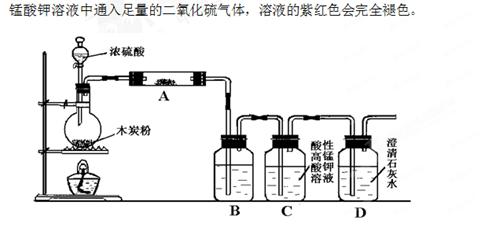
(1)组装好上述装置后,首先要进行的操作是: 。
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式: 。
(3)用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入试剂的名称及其作用:A中加入的试剂和作用是 、 ;B中加入的试剂和作用是 、 。
(4)实验时,C中应观察到什么现象,才可以说明生成了二氧化碳: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了Cl元素的非金属性比Br强的实验研究。回答下列问题: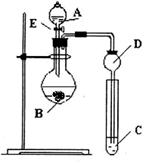
(1)图中E装置名称是_____________。
(2) N、C、Si的非金属性由强到弱的顺序是:_____________;从以下所给物质中选出甲同学设计的实验所用到物质:试剂A为_______;试剂C为_________(填序号)。
①稀HNO3溶液 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2
(3) 乙同学设计的实验中(酒精灯加热装置在图中未画出),若试剂C为溴化钾溶液溶液外,还需要用到的试剂有:试剂A为________;试剂B为 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
如图是一个制取氯气并以氯气为原料进行特定反应的装置。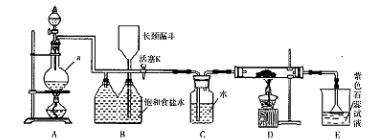
(l)A是氯气发生装置,写出其中的化学反应方程式 。
(2)a仪器的名称为 。
(3)实验开始时,先点燃A处的酒精灯,打开活塞K,让氯气充满整个装置,再点燃D处酒精灯,连接上E装置。D装置的硬质玻璃管内盛有炭粉,反应产物为CO2和HC1。写出D中反应的化学方程式 ,装置C的作用是 。
(4)在E处,若漏斗内气体带有黄绿色,则紫色石蕊试液的颜色变化为 。
(5)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为 (填序号)。
①有白色沉淀生成;②无白色沉淀生成;③先生成白色沉淀,而后白色沉淀消失。
(6)D处反应完毕后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有Cl2
产生,则装置B中的现象是 ;若发现装置B中该现象不明显,可能的
原因是 ;查找原因时可用肥皂水或湿润的碘化钾淀粉试纸等,若用蘸
有浓氨水的玻璃棒检查时观察到有白烟产生,写出该氧化还原反应的化学方程
式 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
相关信息:①四氯化硅遇水极易水解;②SiCl4沸点为57.7℃,熔点为-70.0℃。请回答:
(1)写出装置A中发生反应的离子方程式 。
(2)装置C中的试剂是 ;装置F的作用是 ;
装置E中的h瓶需要冷却的理由是 。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
①反应的离子方程式: 。
②滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
③滴定前检验Fe3+是否被完全还原的实验操作是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置:(部分夹持装置已略去)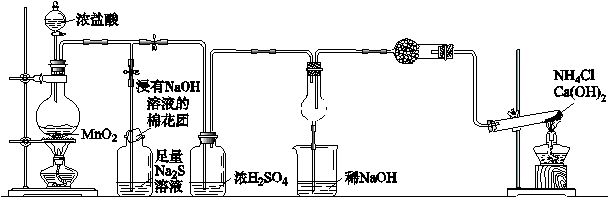
A B C D E
(1)写出A中反应的离子方程式 。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式 。
(3)试从原子结构角度解释氯的氧化性大于硫的原因 。
(4)D中干燥管中出现的现象及化学方程式 。
(5)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,请画出其装置图 (并注明盛装试剂)。
(6)还有什么方法能证明氧化性Cl2 > S,用一种相关事实说明 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com