
新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn、Ni且均显+2价,下同)由铁酸盐(MFe2O4)经高温还原而得。常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:

(1)已知铁酸盐(MFe2O4)被H2高温还原时,发生反应的MFe2O4与H2的物质的量之比为 2︰1,则还原产物 MFe2Ox 中x=______,MFe2Ox 中+2价铁与+3价铁的量之比为_____。
(2)在酸性溶液中,Fe2O42-易转化为Fe2+:Fe2O42-+2e-+8H+→2Fe2++4H2O有 KMnO4、Na2CO3、Cu2O、Fe2(SO4)3 四种物质中的一种能使上述还原过程发生,写出该氧化还原反应的离子方程式并配平_________________。
【知识点】计算、氧化还原反应 A1 B3 B1
【答案解析】(1)3.5 1:1 (每空2分)
(2)Fe2O42-+Cu2O+10H+=2Fe2++2Cu2++5H2O (3分)
解析:(1)根据元素化合价代数和为0知化合物MFe2O4中铁元素的化合价为+3(设Fe的化合价为x,则+2+2x+(-2×4)=0,x=+3),1mol氢气在反应中失去电子2mol,则2mol MFe2O4中的Fe得到电子2mol,即只有2molFe3+得到电子,则MFe2Ox中的2个Fe,1个是+2价,1个是+3价,因此x=3.5,MFe2Ox 中+2价铁与+3价铁的量之比为1:1.
⑵由于Fe2O42-转化为Fe2+是还原反应,因此需加还原剂,即加Cu2O,反应为Fe2O42-+Cu2O+10H+=2Fe2++2Cu2++5H2O。
【思路点拨】本题⑵的氧化还原反应的配平:首先根据氧化还原反应得失电子相等配平氧化剂、还原剂、氧化产物和还原产物Fe2O42-+Cu2O=2Fe2++2Cu2+,再根据电荷守恒确定左边加10个H+,最后根据原子守恒配平。


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
工业生产纯碱的工艺流程示意图如下:
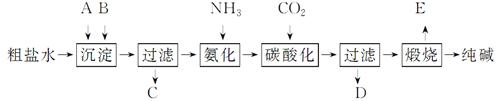
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A ,B 。
(2)实验室提纯粗盐的实验操作依次为:
取样、 、沉淀、 、 、冷却结晶、 、烘干。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是______。碳酸化时没有析出碳酸钠晶体,其原因是______。
(4)碳酸化后过滤,滤液D最主要的成分是_____
(填写化学式),检验这一成分的阴离子的具体方法是____。
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为: 。滤液D加石灰水前先要加热,原因是 。
(6)产品纯碱中含有碳 酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:________(注明你的表达式中所用的有关符合的含义)。
酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:________(注明你的表达式中所用的有关符合的含义)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表格中的各种情况,可以用下面的图象曲线表示的是( )
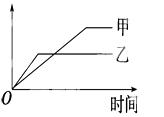
| 反应 | 纵坐标 | 甲 | 乙 | |
| A | 等质量的钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
| B | 相同质量氨,在同一容器中2NH3 | 氨气的转化率 | 500℃ | 400℃ |
| C | 在体积可变的恒压容器中,体积比1:3的N2、H2,2NH3 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
| D | 2molSO2与1molO2,在相同温度下2SO2+O2 | SO3物质的量 | 10个大气压 | 2个大气压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,4 gCH4含有NA个C-H共价键
B. 1 mol Fe与足量稀HNO3反应,转移2NA个电子
C.1 L 0. 1 mol/L NaHCO3溶液中含有0. 1NA个HCO3-
D.常温常压下,22.4 LNO2和CO2的混合气体中含有2NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
烧碱、纯碱等都是重要的化工原料。
(1)利用如图装置可以证明二氧化碳与烧碱溶液发生了反应。
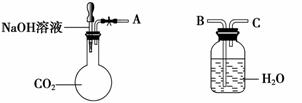
①若将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是______
_____________________________________________________________。
②若其他操作不变,将A与C连接,可观察到的现象是_____________________。
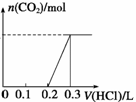
(2)向100 mL 1 mol·L-1烧碱溶液中通入一定量CO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按出现的先后顺序分别是Ⅰ.NaOH、Na2CO3,Ⅱ.__________________,Ⅲ.Na2CO3、NaHCO3,Ⅳ.__________________。
①常温下,将得到的固体X重新溶于水,在所得溶液中逐滴加入盐酸,得到下面的变化图,则X的成份为 (填Ⅰ、Ⅱ、Ⅲ或Ⅳ),盐酸的浓度为 。
②若要验证白色固体X是第Ⅰ种组成,依次加入的试剂为________(填字母序号)。
a.盐酸 b.MgCl2溶液 c.BaCl2溶液 d.Ba(OH)2溶液
在验证的过程中,一定需要进行的操作是________(填字母序号)。
a.萃取 b.洗涤 c.过滤 d.分馏
③若白色固体X为第Ⅲ种组成,下列实验方案中不能测定其中NaHCO3质量分数的是________(填字母序号)。
a.取m g X与足量Ba(OH)2溶液充分反应,过滤,洗涤,烘干得n g固体
b.取m g X与足量盐酸充分反应,加热,蒸干,灼烧得n g固体
c.取m g X充分加热,减重n g
d.取m g X与足量稀硫酸充分反应,逸出的气体被足量碱石灰吸收,增重n g
④若白色固体X的质量为5.0 g,则X的组成为________(填Ⅰ、Ⅱ、Ⅲ或Ⅳ)。
查看答案和解析>>
科目:高中化学 来源: 题型:
卤族元素包括F、Cl、Br等。
(1)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是________。
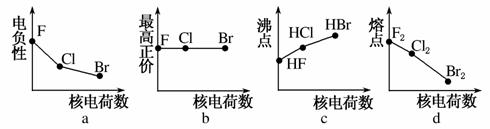
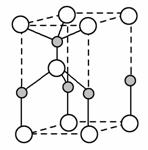
(2)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,右图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为________,该功能陶瓷的化学式为________。
(3)BCl3和NCl3中心原子的杂化方式分别为________和________。第一电离能价于B、N之间的第二周期元素有________种。
(4)若BCl3与XYn通过B原子与X原子间的配位键结合形成配合物,则该配合物中提供孤对电子的原子是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图
 (1)图I表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为5,量筒中液体体积是 mL。
(1)图I表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为5,量筒中液体体积是 mL。
(2)图II表示25mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号) 。
A.是a mL B.是(25-a)mL
C.一定大于a mL D.一定大于(25-a)mL
(3)写出下列物质的水解离子方程式
NaClO溶液: Fe2 (SO4)3 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,将V L  A气体(摩尔质量是M g/mol)溶于0.1 L水中,所得溶液的密度为d g/cm3,则此溶液的物质的量浓度为 ( )
A气体(摩尔质量是M g/mol)溶于0.1 L水中,所得溶液的密度为d g/cm3,则此溶液的物质的量浓度为 ( )
A.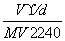 B.
B.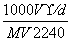
C.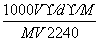
 D.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com