
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
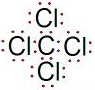 ,空间构型为正四面体.
,空间构型为正四面体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
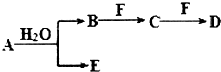 A、B、C、D、E、F为中学化学中的常见物质,且物质A由l~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题:(请用具体的元素符号及化学用语作答)
A、B、C、D、E、F为中学化学中的常见物质,且物质A由l~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题:(请用具体的元素符号及化学用语作答)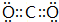 ;D的化学式为NaHCO3.
;D的化学式为NaHCO3. ,D属于共价化合物(填“共价”或“离子”);
,D属于共价化合物(填“共价”或“离子”);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应一定是断开反应物中的化学键吸收的能量比形成生成物中的化学键放出的能量少 | |
| B. | 1molH2SO4和1molBa(OH)2完全反应所放出的热量称为中和热 | |
| C. | 反应物的总能量低于生成物的总能量的化学反应为放热反应 | |
| D. | 在化学反应中需要加热的反应就是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
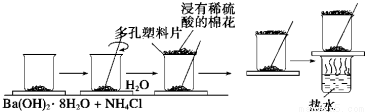
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
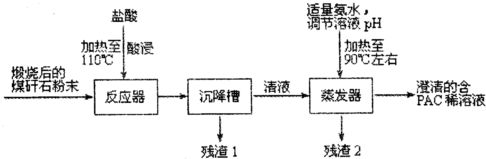
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com