
分析 D和E互为同分异构体.则D和E分子中碳原子个数相等,当D和E的混合物与碱性KMnO4溶液共热后酸化,得到四种酸,根据D、E碳原子个数相等知,HOOC(CH2)10COOH和CH3(CH2)4COOH是由同一种烯烃得到的,CH3(CH2)7COOH和HOOC(CH2)7COOH是由同一种烯烃得到的,将两种酸中羧基去用碳碳双键连接即可得到相应烯烃;B跟氢气发生的是加成反应,D与E不同的话是应该加成的地方不同产生的,所以按题意可以得到B有两个双键CH3(CH2)4CH═CHCH2CH═CH(CH2)7COOH,据此分析解答.
解答 解:D和E互为同分异构体.则D和E分子中碳原子个数相等,当D和E的混合物与碱性KMnO4溶液共热后酸化,得到四种酸,根据D、E碳原子个数相等知,HOOC(CH2)10COOH和CH3(CH2)4COOH是由同一种烯烃得到的,CH3(CH2)7COOH和HOOC(CH2)7COOH是由同一种烯烃得到的,将两种酸中羧基去用碳碳双键连接即可得到相应烯烃,D、E结构简式分别为CH3(CH2)7CH═CH(CH2)7COOH、CH3(CH2)4CH═CH(CH2)10COOH;B跟氢气发生的是加成反应,D与E不同的话是应该加成的地方不同产生的,所以按题意可以得到B有两个双键CH3(CH2)4CH═CHCH2CH═CH(CH2)7COOH,
(1)通过以上分析知,D、E结构简式分别为CH3(CH2)7CH═CH(CH2)7COOH、CH3(CH2)4CH═CH(CH2)10COOH,
故答案为:CH3(CH2)7CH═CH(CH2)7COOH、CH3(CH2)4CH═CH(CH2)10COOH;
(2)通过以上分析知,B结构简式为CH3(CH2)4CH═CHCH2CH═CH(CH2)7COOH,故答案为:CH3(CH2)4CH═CHCH2CH═CH(CH2)7COOH.
点评 本题考查有机物推断,侧重考查学生获取信息利用信息能力,根据产物结构简式确定碳碳双键位置是解本题关键,难点是判断B结构简式,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LNaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 等浓度等体积的Na2CO3溶液与NaClO溶液混合后:2c(Na+)=3c(ClO-)+3c(HClO)+3c(HCO3-)+3c(CO32-)+3c(H2CO3) | |
| C. | 室温下,KOH与苯酚混合pH=7的溶液中:c(K+)>c(C6H5O-)>c(H+)=c(OH-) | |
| D. | 某温度下,水的离子积常数Kw=10-13,在此温度下,将pH=12的NaOH溶液Va L与pH=2的硫酸Vb L混合,所得溶液呈中性,则Va:Vb=10:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸钠溶液加入稀硝酸:SO32-+2H+=SO2↑+H2O | |
| B. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
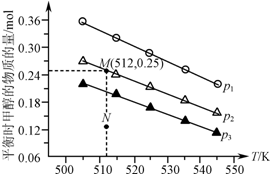 在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法正确的是( )
在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法正确的是( )| A. | 该反应的正反应为放热反应 | |
| B. | 压强大小关系为p1<p2<p3 | |
| C. | M点对应的平衡常数K的值约为1.04×10-2 | |
| D. | 在p2及512 K时,图中N点v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH与CH2=CHCH2OH | |
| B. | CH3OH与HO-CH2-CH2-OH | |
| C. | HO-CH2-CH2-OH与HO-CH2-CH2-CH2-OH | |
| D. |  与 与 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 检验淀粉是否水解生成葡萄糖 | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后水解液用NaOH溶液中和,然后再加入新制Cu(OH)2浊液,加热,观察是否有红色沉淀生成 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 用 品 |  |  |  |  |
| 主要成分 | CO2 | Fe2O3 | NaHCO3 | CH3COOH |
| 用途 | 做制冷剂 | 做红色涂料 | 除油污 | 做调味剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如图所示.下列叙述正确的是( )
常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如图所示.下列叙述正确的是( )| A. | 所用HCl的浓度是0.09mol•L─1,NaOH溶液浓度为0.03mol•L-1 | |
| B. | 在B点,溶液中离子浓度关系为:c(Na+)>c(Cl-)>c(H+)>c(OH-) | |
| C. | A.B.C三点水的电离程度大小依次为:A>B>C | |
| D. | 滴定前,锥形瓶用待测液润洗,导致HCl浓度偏低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com