
【题目】近日我国科研人员发明了可充电的Al-CO2电池(结构如图所示)。电池放电时的反应为4Al+9CO2===2Al2(CO3)3+3C。下列说法正确的是

A. 放电时铝电极发生还原反应
B. 放电时的正极反应为9CO2+12e-=6CO32-+3C
C. 放电时物质的化学能100%转化为电能
D. 充电时铝电极应与外接直流电源的正极相连
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.保护环境,提倡“低碳生活”,是我们都应关注的社会问题。目前,一些汽车已改用天然气(CNG)做燃料,以减少对空气污染。已知:16g甲烷完全燃烧生成液压态水放出890kJ热量,1mol碳完全燃烧生成二氧化碳放出393.5kJ热量,通过计算比较,填写下列表格(精确到0.01):
物质质量1g | 燃烧放出的热量/kJ | 生成CO2的质量/g |
碳 | 32.80 | _________ |
甲烷 | _________ | 2.75 |
根据表格中的数据,天然气与煤相比,用天然气做燃料的优点是 ____________。
II.联合国气候变化大会于2009年12月7~18日在哥本哈根召开。中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%。
(1)用CO2和氢气合成CH3OCH3(甲 醚 )是解决能源危机的研究方向之一。
已知:CO(g)+2H2(g)= CH3OH(g) △H1 = -90.7kJ·mol-1
2CH3OH(g)= CH3OCH3(g)+H2O(g) △H2 = -23.5kJ·mol-1
CO(g)+H2O(g)= CO2(g)+H2(g) △H3= -41.2kJ·mol-1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为:_____________________________ 。
(2)恒温下,一体积固定的密闭容器中存在反应CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H<0,若增大CO的浓度,则此反应的焓变___________(填“增大”、“减小”、“不变”)。
CO2(g)+H2(g) △H<0,若增大CO的浓度,则此反应的焓变___________(填“增大”、“减小”、“不变”)。
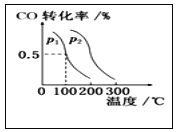
(3)在催化剂和一定温度、压强条件下,CO与H2可反应生成 甲醇:CO(g)+2H2(g)![]() CH3OH(g), CO的平衡转化率与温度、压强的关系如图所示,则:p1_______________ p2 (填“>”、 “<”或“ = ”,下同),该反应的△H___________0。
CH3OH(g), CO的平衡转化率与温度、压强的关系如图所示,则:p1_______________ p2 (填“>”、 “<”或“ = ”,下同),该反应的△H___________0。
(4)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能:E(P-P)=akJ·mol-1、E(P-O)=bkJ·mol-1、E(O=O)=ckJ·mol-1,则反应P4(白磷)燃烧生成P4O6的热化学方程式为(反应热用a、b、c表示):_____________________。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有![]()
B.某溶液中加![]() 溶液生成白色沉淀,说明原溶液中有
溶液生成白色沉淀,说明原溶液中有![]()
C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有![]()
D.某溶液中加稀硫酸溶液生成无色无味气体,说明原溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图所示)。下列叙述正确的是

A. 图中涉及的物质都是电解质
B. SO2→SO3的过程是吸热过程
C. 图中涉及的无机化合物在一定条件下均具有氧化性
D. 理论上图中氧化物和水的反应都能设计成原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的一组是
A. H和D互为同位素 B. 丁烯和环丁烷互为同分异构体
C. 碳链![]() 与
与 ![]() 的烃为同系物 D. 金刚石、石墨和C60为同素异形体
的烃为同系物 D. 金刚石、石墨和C60为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组拟对SO2和亚硫酸的性质进行探究。请回答下列问题:
Ⅰ.探究SO2和Fe(NO3)3溶液的反应
该小组用图所示装置达成实验目的。已知:1.0mol/L Fe(NO3)3溶液的pH=1。
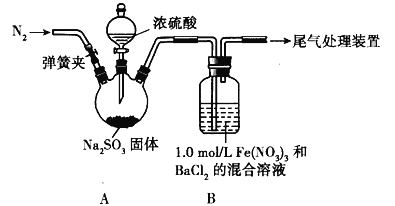
(1)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是_____。
(2)装置B中产生了白色沉淀,说明SO2具有_____性。
(3)分析B中产生白色沉淀的原因:
①观点1:SO2与Fe3+反应;观点2:酸性条件下,SO2与NO3﹣反应;观点3:_____。
②按观点1,装置B 中反应的离子方程式为_____,为证明该观点,应进一步确认生成的新物质,实验操作及现象是_____。
③按观点2,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。此时应选择的最佳溶液是_____(填序号)。
a.0.1mol/L 稀硝酸
b.1.5mol/L Fe(NO3)2
c.3.0mol/L NaNO3溶液和0.1mol/L硫酸等体积混合的溶液
d.6.0mol/L NaNO3溶液和0.2mol/L盐酸等体积混合的溶液
Ⅱ.探究H2SO3的酸性强于HClO。
该小组用图所示装置达成实验目的。
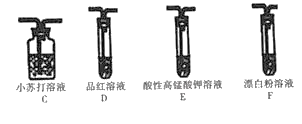
(4)装置的连接顺序为:纯净SO2→_____(选填字母),F中反应的离子方程式为_____。
(5)可证明H2SO3的酸性强于HClO的实验现象是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.72g金属钠、氧化钠和过氧化钠的混合物与足量水反应,在标准状况下得到672mL混合气体,将混合气体电火花点燃,恰好完全反应,则原混合物中钠、氧化钠、过氧化钠的物质的量之比为( )
A. 3:2:1 B. 4:2:1 C. 2:1:1 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺”中,理想状态是反应中原子全部转化为欲制得产物,即原子的利用率为100%.在用丙炔合成甲基丙烯酸甲酯![]() 的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要其他的反应物是
的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要其他的反应物是
A. CH2=CH2和CO B. CO和CH3OH C. CH3OH和H2 D. CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素的某些性质如下表所示,有关说法正确的是![]()
![]()
元素 | 元素的相关信息 |
R | 最高正价与最低负价的绝对值之和等于2 |
W | 原子的M电子层上有3个电子 |
X | 在短周期主族元素中,其原子半径最大 |
Y | 最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反应生成淡黄色单质 |
Z | 最高价氧化物的水化物为一种强酸,可与其简单气态氢化物反应生成盐 |
A. Z、X、W的简单离子半径依次增大
B. W与Y、X与R分别形成的化合物都能与水反应,且有气体生成
C. R与Y、Z分别形成的化合物均只含有极性键
D. 常温下X、Y、Z的最高价氧化物的水化物的浓溶液都能与单质W持续反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com