
【题目】常温下,向![]()
![]() 溶液中加入
溶液中加入![]() 晶体或加水稀释时,都会引起
晶体或加水稀释时,都会引起
A.溶液中 增大B.溶液中
增大B.溶液中![]() 增大
增大
C.溶液的导电能力减小D.![]() 的电离程度增大
的电离程度增大
【答案】A
【解析】
![]() 溶液加水稀释,电离平衡向正方向移动,电离程度增大,由于溶液体积增大,所以溶液中
溶液加水稀释,电离平衡向正方向移动,电离程度增大,由于溶液体积增大,所以溶液中![]() 减小,溶液的pH增大,导电能力减弱;
减小,溶液的pH增大,导电能力减弱;![]() 溶液加入少量
溶液加入少量![]() 晶体时,
晶体时,![]() 增大,导电能力增强,电离平衡向逆方向移动,电离程度减小,溶液中
增大,导电能力增强,电离平衡向逆方向移动,电离程度减小,溶液中![]() 减小,溶液的PH增大。
减小,溶液的PH增大。
A.![]() 溶液加水稀释,平衡向正方向移动,电离程度增大,则
溶液加水稀释,平衡向正方向移动,电离程度增大,则![]() 增大、
增大、![]() 减小,所以溶液中
减小,所以溶液中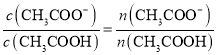 增大;
增大;![]() 溶液中加入
溶液中加入![]() ,平衡向逆方向移动,
,平衡向逆方向移动,![]() 减小,
减小,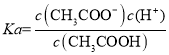 不变,则
不变,则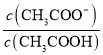 增大,故A正确;
增大,故A正确;
B.![]() 溶液加水稀释,由于溶液体积增大,所以溶液中
溶液加水稀释,由于溶液体积增大,所以溶液中![]() 减小,加入少量
减小,加入少量![]() 晶体时平衡向逆方向移动,溶液中
晶体时平衡向逆方向移动,溶液中![]() 减小,故B错误;
减小,故B错误;
C.![]() 溶液加水稀释,离子浓度减小,溶液的导电能力减弱,加入少量
溶液加水稀释,离子浓度减小,溶液的导电能力减弱,加入少量![]() 晶体时,离子浓度增大,溶液的导电能力增强,故C错误;
晶体时,离子浓度增大,溶液的导电能力增强,故C错误;
D.加水稀释,促进醋酸电离,![]() 的电离程度增大,加入少量
的电离程度增大,加入少量![]() 晶体时平衡向逆反应方向移动,电离程度减小,故D错误;
晶体时平衡向逆反应方向移动,电离程度减小,故D错误;
选A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机化合物说法正确的是( )
A. 可用高锰酸钾溶液鉴别甲苯、环己烯与溴苯
B. ![]() 是由单体CH2=CH—CH3和CH2=CH2发生加聚反应的产物
是由单体CH2=CH—CH3和CH2=CH2发生加聚反应的产物
C. 石油裂解和油脂皂化都是由高分子化合物生成小分子物质的过程
D. 淀粉与纤维素互为同分异构体,二者水解的最终产物相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)镍氢碱性充电电池被誉为“绿色化学电源”,充、放电时的反应:![]() 。放电时,正极的电极反应式为 ______ ,充电时,该电极应与电源的 ______
。放电时,正极的电极反应式为 ______ ,充电时,该电极应与电源的 ______ ![]() 填“正”或“负”
填“正”或“负”![]() 极相连.
极相连.
(2)氨在氧气中燃烧,生成水和氮气。已知:![]() ;
;![]() ,
,![]() ;
;![]() ,则氨在氧气中燃烧生成液态水和氮气时的热化学方程式为: ______ 。
,则氨在氧气中燃烧生成液态水和氮气时的热化学方程式为: ______ 。
(3)研究表明工业上合成氨反应![]() 在
在![]() 、
、![]() 的平衡常数分别为
的平衡常数分别为![]() 和200。
和200。
①合成氨是 ______ 反应![]() 填“放热”或“吸热”
填“放热”或“吸热”![]() 。
。
②合成氨选择![]() 的原因是: ______ 。
的原因是: ______ 。
③在容积固定的密闭容器中发生上述反应,如表中为各物质在不同时刻的浓度:
时间 |
|
|
|
0 |
|
| 0 |
5 |
| X |
|
10 |
|
|
|
![]() ,
,![]() 的平均反应速率
的平均反应速率![]() ______。反应在5分钟时,条件发生了改变,改变的条件可能是 ______
______。反应在5分钟时,条件发生了改变,改变的条件可能是 ______ ![]() 填序号
填序号![]() 。
。
![]() 使用催化剂
使用催化剂 ![]() 降低温度
降低温度 ![]() 增加氢气的浓度
增加氢气的浓度 ![]() 分离出
分离出![]()
(4)在![]() 时,液氨中存在电离平衡
时,液氨中存在电离平衡![]() ,离子积常数
,离子积常数![]() 。若一定条件下,平衡时
。若一定条件下,平衡时![]()
![]() ,下列说法正确的是 ______ 。
,下列说法正确的是 ______ 。
![]() ,液氨的离子积常数增大
,液氨的离子积常数增大
![]() 此温度下液氨的离子积常数为
此温度下液氨的离子积常数为![]()
![]() 液氨在
液氨在![]() 的电离程度比常温下纯水的大
的电离程度比常温下纯水的大
(5)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:![]() ,下列叙述正确的是 ______
,下列叙述正确的是 ______ ![]() 填字母
填字母![]() 。
。
A. 放电时负极反应为:![]()
B. 充电时阳极反应为:![]()
C. 放电时每转移3mol电子,正极有![]() 被氧化。
被氧化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二胺![]() ,无色液体,有类似氨的性质。已知:
,无色液体,有类似氨的性质。已知:![]() 时,
时,![]() ,
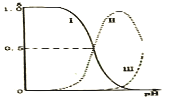
,![]() ;乙二胺溶液中各含氮微粒的分布分数
;乙二胺溶液中各含氮微粒的分布分数![]() 平衡时某含氮微粒的浓度占各含氮微粒浓度之和的分数
平衡时某含氮微粒的浓度占各含氮微粒浓度之和的分数![]() 随溶液pH的变化曲线如图。下列说法错误的是
随溶液pH的变化曲线如图。下列说法错误的是
A.![]() 在水溶液中第一步电离的方程式为:
在水溶液中第一步电离的方程式为:![]()
B.曲线Ⅰ代表的微粒符号为![]()
C.曲线Ⅰ与曲线Ⅱ相交点对应![]()
D.在![]()
![]() 溶液中各离子浓度大小关系为
溶液中各离子浓度大小关系为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积和pH都相同的盐酸和AlCl3溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )

A.Al(OH)3的电离方程式为:Al(OH)3=Al3++3OH-
B.a点溶液中有: c(H+)+c(Al3+)=c(OH-) +3c(Cl-)
C.曲线X表示盐酸稀释过程的pH变化
D.b、c两溶液c(OH-)及c(Cl-)均相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定环境中一定能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO3、SO42、Na+
B.存在较多Fe3+的溶液中:Na+、SCN、CO32、K+
C.常温下水电离出的c(H+)=10-12mol/L的溶液中::NH4+、Cl、CO32、F
D.在能使红色石蕊试纸变蓝色的溶液中:Na+、CO32、S2、NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙基叔丁基醚(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂。用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应的化学方程式为:C2H5OH(g)+IB(g)ETBE(g)△H.回答下列问题:
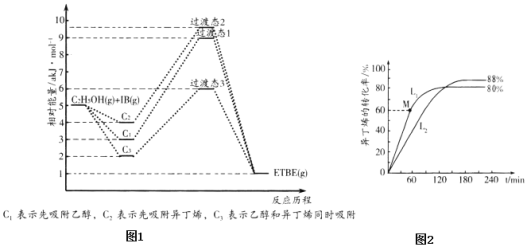
(1)反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图1所示,该反应的△H=______a kJmol-1.反应历程的最优途径是______(填C1、C2或C3)。
(2)在刚性容器中按物质的量之比1:1充入乙醇和异丁烯,在378K与388K时异丁烯的转化率随时间变化如图2所示。
①378K时异丁烯的转化率随时间变化的曲线为______(填L1或L2)。
②388K时,以物质的量分数表示的化学平衡常数K=______。(物质的量分数为某组分的物质的量与总物质的量的比)
③已知反应速率v=v正-v逆=k正x(C2H5OH)x(IB)-k逆x(ETBE),其中秒正为正反应速率,v逆为逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数,计算M点![]() =______(保留到小数点后 1位)。
=______(保留到小数点后 1位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L庚烷的分子数约为NA
B.1 L0.1mol/L的Na2S溶液中S2-和HS-的总数为0.1NA
C.4.0 g![]() 与D2O的混合物中所含中子数为2NA
与D2O的混合物中所含中子数为2NA
D.50 mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com