
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 3.6g重水中含有的中子数为2NA
B. 16.0g的过氧(根)离子中含有的电子数为9NA
C. 100mL 3.0mol/L的盐酸与5.6g铁屑完全反应转移的电子数为0.3NA
D. 含2mol H2SO4的浓硫酸与足量金属铜完全反应,产生SO2分子数为NA
考点: 阿伏加德罗常数.
分析: A.一个重水D2O分子含中子数为10,式量为20;
B.过氧根离子中含有18个电子,摩尔质量为32g/mol;
C.铁与盐酸反应生成氯化亚铁,计算出铁粉和氯化氢的物质的量,先判断过量情况,然后根据不足量计算出转移电子数;
D.随着反应的进行,浓硫酸变成稀硫酸,反应停止,则反应生成的二氧化硫减少.
解答: 解:A.则3.6g重水的物质的量为: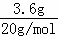 =0.2mol,0.2mol重水中含有2mol中子,含有的中子数为1.8NA,故A错误;
=0.2mol,0.2mol重水中含有2mol中子,含有的中子数为1.8NA,故A错误;
B.16g过氧根离子(O22﹣)的物质的量为: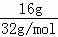 =0.5mol,0.5mol过氧根离子中含有9mol电子,含有的电子数为9NA,故B正确;
=0.5mol,0.5mol过氧根离子中含有9mol电子,含有的电子数为9NA,故B正确;
C.100mL 3.0mol/L的盐酸中含有0.3molHCl,5.6g铁屑的物质的量为: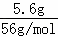 =0.1mol,铁不足,0.1mol铁完全反应消耗0.2mol氯化氢,转移了0.2mol电子,完全反应转移的电子数为0.2NA,故C错误;
=0.1mol,铁不足,0.1mol铁完全反应消耗0.2mol氯化氢,转移了0.2mol电子,完全反应转移的电子数为0.2NA,故C错误;
D.铜与浓硫酸作用:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,反应过程中浓度逐渐减小,稀硫酸不与铜反应,则参加反应的浓硫酸小于2mol,故产生的SO2分子数小于NA,故D错误;
CuSO4+SO2↑+2H2O,反应过程中浓度逐渐减小,稀硫酸不与铜反应,则参加反应的浓硫酸小于2mol,故产生的SO2分子数小于NA,故D错误;
故选B.
点评: 本题考查了阿伏伽德罗常数的计算与判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:
下列对化学知识概括合理的是()
A. 酸性氧化物都是非金属氧化物
B. 一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
C. 丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
D. 熔融状态能导电的物质一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
用NaOH固体配制250mL 0.2mol•L﹣1 NaOH溶液.
(1)经计算需用NaOH固体 g
(2)配制该溶液用到的仪器有除托盘天平、烧杯、玻璃棒、量筒外,还有容量瓶;
(3)容量瓶上标有以下五项中的 (填序号)
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(4)配制溶液时,正确的操作顺序是(用字母表示,每个字母只能用一次) 并完成横线上的内容.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需质量的NaOH,放入烧杯,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液 .
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(5)在配制上述溶液实验中,下列操作引起结果(浓度)偏低的有 (填序号).
A.没有用蒸馏水洗烧杯2~3次,未将洗液移人容量瓶中
B.定容时,加水超过了刻度线,倒出一些再重新加水到刻度线
C.容量瓶刚用蒸馏水洗净,没有烘干.
查看答案和解析>>
科目:高中化学 来源: 题型:
国外新近研制的溴化锌蓄电池的基本构造是用碳棒作两极,溴化锌溶液作电解液. 现有四个电极反应:①Zn﹣2e=Zn2+ ②Zn2++2e=Zn ③Br2+2e=2Br﹣ ④2Br﹣﹣2e=Br2.那么,充电时的阳极和放电时的负极反应分别是()
A. ④① B. ②③ C. ③① D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
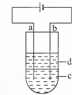
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如下图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁.
(1)a电极材料应为 ,电极反应式 ;
(2)电解液c可以是(填编号)
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为 ,在加入苯之前对c应作怎样的简单处理? .
(4)为了在较短时间内看到白色沉淀,可采取的措施(填编号)
A.改用稀硫酸作电解液
B.适当增大电源的电压
C.适当减少两电极间距离
D.适当降低电解液的温度
(5)若c为Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质的检验说法正确的是( )
A. 将某气体通入品红溶液中,品红溶液褪色,加热后溶液恢复红色,则该气体一定是SO2
B. 钾元素焰色反应的操作:用铂丝蘸取氯化钾置于煤气灯的火焰上进行灼烧,直接观察其焰色
C. NH4+的检验:向待检液中加入NaOH溶液并加热,可生成使湿润的蓝色石蕊试纸变红的气体
D. 待检液加入盐酸可生成使澄清石灰水变浑浊的无色气体,则待检液中一定含有CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
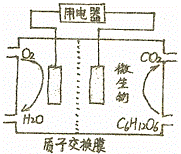
糖类物质为很多生物生命活动提供能量.
(1)已知 45g葡萄糖在人体内完全氧化为二氧化碳和水,放出701KJ的热量,该反应的热化学方程式 .
(2)以葡萄糖为燃料的微生物燃料电池结构如图所示,其负极反应为: .电池工作过程中溶液中氢离子移动方向从 极区移向 极区(填“正”或“负”)
(3)常温下,用上述电池惰性电极电解100L某浓的硫酸铜溶液,当溶液PH=1时停止电解,则理论上需要葡萄糖的质量为 (假设溶液体积不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com