
| A. | 二氧化碳的比例模型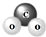 | |
| B. | 原子核内有10个中子的原子:${\;}_{8}^{16}$C | |
| C. | Fe3+的最外层电子排布式为3s23p63d5 | |
| D. | Cu基态的外围电子排布图: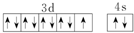 |
分析 A、二氧化碳为直线型分子;
B、碳原子的质子数为6;
C、Fe元素基态原子核外电子排布式为1s22s22p63s23p63d64s2,可知在3d上存在4个未成对电子,先失去4s上的2个电子后、再失去3d上的1个电子形成Fe3+;
D、Cu原子核外有29个电子,其3d、4s电子为其外围电子.
解答 解:A、二氧化碳的比例模型为 ,故A错误;
,故A错误;
B、碳原子的质子数为6,故原子核内有10个中子的碳原子的质量数为16,则为166C,故B错误;
C、Fe元素基态原子核外电子排布式为1s22s22p63s23p63d64s2,可知在3d上存在4个未成对电子,先失去4s上的2个电子后、再失去3d上的1个电子形成Fe3+,Fe3+的最外层电子排布式为3s23p63d5,故C正确;
D、Cu原子核外有29个电子,其3d、4s电子为其外围电子,所以其外围电子排布式为3d104s1,故D错误.
故选C.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、比例模型等,难度不大,注意对基础知识的理解掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯原子的结构示意图: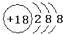 | |
| B. | HClO的结构式为:H-Cl-O | |
| C. | 氯化镁的电子式: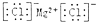 | |
| D. | 用电子式表示氯化氢分子的形成过程:H•+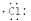 →H+ →H+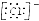 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16.5克过氧化钾晶体中,含0.3NA个阴离子 | |
| B. | 1mol铜粉与硫粉充分反应可转移2mol电子 | |
| C. | 含等物质的量溶质的NaHSO4溶液和Na2SO4 溶液中,均含2NA个阳离子 | |
| D. | 20 g NH3T+中含有中子数为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为三角锥形 | |
| C. | BF3是三角锥形分子 | |
| D. | SiF4和SO32-的中心原子均为sp2杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用KMnO4(H+)溶液鉴别甲苯、丙烯、已烷 | |
| B. | 用溴水鉴别苯、丙烯、四氯化碳 | |
| C. | 用水鉴别乙醇、苯、四氯化碳 | |
| D. | 用NaOH溶液鉴别溴乙烷、甲苯、硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
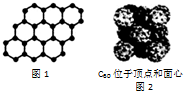
| A. | SiO2晶体中最小环上的原子数为6 | |
| B. | 在晶体中只要有阳离子就一定有阴离子 | |
| C. | 12g石墨烯(如图1)中含有六元环的个数为0.5NA | |
| D. | 720g C60晶体(如图2)中含有0.5NA个晶胞结构单元 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com