
| 含氧酸 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH | 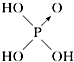 | 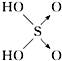 | 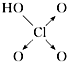 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 ,H3PO3与过量的NaOH溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O;
,H3PO3与过量的NaOH溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O; ,在H3AsO3中加入浓盐酸,反应的化学方程式为As(OH)3+3HCl=AsCl3+3H3O.
,在H3AsO3中加入浓盐酸,反应的化学方程式为As(OH)3+3HCl=AsCl3+3H3O. 分析 ①含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强,据此确定酸的结构式;H3PO3与过量的NaOH溶液反应的化学方程式为 H3PO3+2NaOH=Na2HPO3+2H2O;
②亚砷酸既有弱酸性又有弱碱性,所以亚砷酸的结构式为: ,亚砷酸和盐酸能反应,反应方程式为As(OH)3+3HCl=AsCl3+3H3O.
,亚砷酸和盐酸能反应,反应方程式为As(OH)3+3HCl=AsCl3+3H3O.
解答 解:①含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强,亚磷酸是中强酸,所以亚磷酸的结构式为 ;H3PO3与过量的NaOH溶液反应的化学方程式为 H3PO3+2NaOH=Na2HPO3+2H2O,故答案为:
;H3PO3与过量的NaOH溶液反应的化学方程式为 H3PO3+2NaOH=Na2HPO3+2H2O,故答案为: ; H3PO3+2NaOH=Na2HPO3+2H2O;
; H3PO3+2NaOH=Na2HPO3+2H2O;
②亚砷酸既有弱酸性又有弱碱性,所以亚砷酸的结构式为 ,亚砷酸和盐酸能反应,反应方程式为As(OH)3+3HCl=AsCl3+3H3O,故答案为:
,亚砷酸和盐酸能反应,反应方程式为As(OH)3+3HCl=AsCl3+3H3O,故答案为: ;As(OH)3+3HCl=AsCl3+3H3O.
;As(OH)3+3HCl=AsCl3+3H3O.
点评 本题考查了酸的性质,明确含氧酸强弱的判断方法即可解答,难度不大.


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:解答题
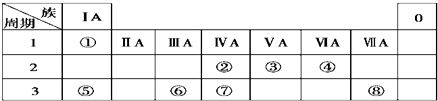
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、E一定处于1、2、3三个不同周期 | |
| B. | A、D不可能在同一主族 | |
| C. | C的最高氧化物的水化物可能显碱性 | |
| D. | C和D的单质不可能化合成1:1型离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| X | Y | Z | W | R | P | Q | |
| 原子半径/nm | 0.154 | 0.074 | 0.099 | 0.075 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | -3,+5 | +3 | ||
| 其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
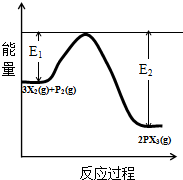
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳和漂白粉作用,生成具有氧化性的物质 | |
| B. | 二氧化硫通入氢硫酸中,使溶液的酸性一定减弱 | |
| C. | 二氧化硫和烧碱反应,使溶液的碱性一定减弱 | |
| D. | 二氧化氮可相互结合为四氧化二氦氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al$\stackrel{氧气,加热}{→}$Al2O3$\stackrel{硝酸}{→}$Al(NO3)3$\stackrel{加热蒸干}{→}$硝酸铝晶体 | |
| B. | Cu$\stackrel{氧气,加热}{→}$CuO$\stackrel{稀硫酸}{→}$CuSO4$\stackrel{蒸干结晶}{→}$胆矾 | |
| C. | Fe$\stackrel{氯气}{→}$FeCl3$\stackrel{过量氨水}{→}$Fe(OH)3$\stackrel{加热}{→}$Fe2O3 | |
| D. | FeSO4溶液$\stackrel{硫化氢、过滤}{→}$FeS |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com