
 如图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极.下列叙述中正确的是( )
如图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极.下列叙述中正确的是( )| A、A处通入空气,B处通入水煤气 |
| B、a电极的反应式包括:CO+4OH--2e-=CO32-+2H2O |
| C、a电极发生还原反应,b电极发生氧化反应 |
| D、如用这种电池电镀铜,当镀件增重6.4g,则消耗标准状况下的水煤气2.24L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCO3+2HCl═CaCl2+H2O+CO2↑ | ||||
B、2HClO
| ||||
| C、Cl2+2KI═2KCl+I2 | ||||
D、Cu+2H2SO4(浓)
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下浓硫酸与铝不发生反应,可在常温下用铝制容器贮藏贮运浓硫酸 |
| B、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| C、二氧化氯具有氧化性,可用于自来水的杀菌消毒 |
| D、铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol H-H键断裂,同时有2 mol H-I键断裂 |
| B、容器内气体的总压强不再变化 |
| C、H2的物质的量浓度不再变化 |
| D、混合气体的颜色不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
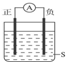
| A、正极Cu,负极Zn,S为稀H2SO4 |
| B、正极Zn,负极Cu,S为CuSO4溶液 |
| C、正极Ag,负极Zn,S为AgNO3溶液 |
| D、正极Fe,负极Cu,S为AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电池 | 电解池 | |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3mol Pb | 生成1mol Al2O3 |
| C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
| D | Pb电极反应质量不变 | Pb电极反应质量不变 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、微粒半径:F->O2->Na+>Li+ |
| B、电负性Cl>C,酸性:HClO4>H2CO3 |
| C、分子中的键角:CH4>H2O>CO2 |
| D、稳定性:LiCl<NaCl<KCl<RbCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com