
 ;
;分析 A、B、C、D、E是五种短周期元素,它们的原子序数依次增大.A元素原子形成的离子核外电子数为零,则A应为H元素;A与C同主族,且C是短周期中原子半径最大的元素,则C为Na元素;B与E同主族,E的原子序数是B的2倍,则B为O元素,E为S元素;则D的最高价氧化物具有两性,即氧化铝为两性氧化物,D为Al元素,然后结合元素化合物性质来解答.
解答 解:A、B、C、D、E是五种短周期元素,它们的原子序数依次增大.A元素原子形成的离子核外电子数为零,则A应为H元素;A与C同主族,且C是短周期中原子半径最大的元素,则C为Na元素;B与E同主族,E的原子序数是B的2倍,则B为O元素,E为S元素;则D的最高价氧化物具有两性,即氧化铝为两性氧化物,D为Al元素,
(1)A与E形成化合物为H2S,其电子式为 ,故答案为:
,故答案为: ;
;
(2)C、D的最高价氧化物的水化物分别为NaOH、Al(OH)3,相互之间反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)A与B形成的原子个数比为1:1和2:1的两种化合物为X和Y,X为H2O2,Y为H2O,由2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑~2e-、2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑~4e-可知,得到等物质的量的B单质时反应中转移的电子数之比是2:4=1:2,故答案为:1:2.
点评 本题考查位置、结构与性质的关系及应用,为高频考点,把握元素的推断为解答的关键,侧重分析与推断能力及元素化合物知识的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1,3-丁二烯和2-丁炔稳定性的相对大小 | |
| B. | 1,3-丁二烯和2-丁炔分子储存能量的相对高低 | |
| C. | 1,3-丁二烯和2-丁炔相互转化的热效应 | |
| D. | 一个碳碳叁键的键能与两个碳碳双键键能之和的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
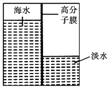 海洋是一个巨大的聚宝盆,含有丰富的矿产资源和水资源,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.
海洋是一个巨大的聚宝盆,含有丰富的矿产资源和水资源,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
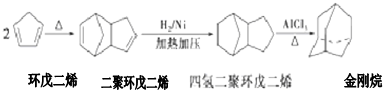
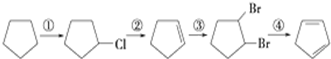
 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr.
+2NaBr.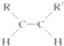 $\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO.请写出下列反应产物的结构简式:
$\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO.请写出下列反应产物的结构简式: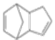 $\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$
$\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$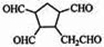 .
. ).若考虑苯环上的烯基侧链经酸性高锰酸钾溶液氧化得羧基,写出A所有可能的结构简式(不考虑立体异构):
).若考虑苯环上的烯基侧链经酸性高锰酸钾溶液氧化得羧基,写出A所有可能的结构简式(不考虑立体异构):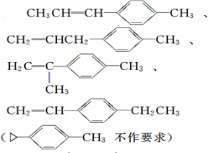 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S Na2CO3 Na2SO3 Na2SO4 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. ④向滤液滴加2滴淀粉溶液,再逐滴加0.100 0mol•L-1碘的标准溶液,至溶液呈紫色不再褪去,消耗碘的标准溶液体积为18.10mL. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2S、Na2CO3, 一定不含有Na2SO4. 操作④发生的反应是: 2S2O${\;}_{3}^{2-}$+I2═S4O${\;}_{6}^{2-}$+2I- 产品纯度:$\frac{9}{w}$×100%. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管只用水洗 | |
| B. | 锥形瓶只用水洗 | |
| C. | 使用甲基橙做指示剂 | |
| D. | 第一次观察酸式滴定管的刻度时仰视 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气通过灼热的CuO粉末 | B. | 碳与SiO2高温反应制粗硅 | ||
| C. | 将锌粒投入Cu(NO3)2溶液 | D. | 镁条在CO2中燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com