
| A. | 与W相邻的同主族元素可制成重要的半导体材料 | |
| B. | 元素的原子半径从大到小的顺序是X、Y、Z | |
| C. | WZ4分子中W、Z 原子最外层均达到8电子结构 | |
| D. | W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2YO4 |
分析 短周期元素W、X、Y、Z的原子序数依次增大,由X2+和Z-离子所带电荷可知,X处于ⅡA族,Z处于ⅦA族,X2+和Z-离子的电子数之差为8,X的阳离子比Z的阴离子少一层电子,则X、Y同周期,由四原子最外层电子数之和为19,则W、Y原子最外层电子数之和为19-2-7=10,故W不能处于IA族,结合原子序数可知,Y一定为主族元素,W不可能处于第三周期,W只能处于第二周期,W和X元素原子内质子数之比为1:2,则X处于第三周期,故X为Mg,则Z为Cl、W为C,Y原子最外层电子数为10-4=6,原子序数大于Mg,故Y为S,据此解答.
解答 解:短周期主族元素W、X、Y、Z的原子序数依次增大,由X2+和Z-离子所带电荷可知,X处于ⅡA族,Z处于ⅦA族,X2+和Z-离子的电子数之差为8,X的阳离子比Z的阴离子少一层电子,则X、Y同周期,由四原子最外层电子数之和为19,则W、Y原子最外层电子数之和为19-2-7=10,故W不能处于IA族,结合原子序数可知,Y一定为主族元素,W不可能处于第三周期,W只能处于第二周期,W和X元素原子内质子数之比为1:2,则X处于第三周期,故X为Mg,则Z为Cl、W为C,Y原子最外层电子数为10-4=6,原子序数大于Mg,故Y为S.
A.与碳相邻的同主族元素为Si,可制成重要的半导体材料,故A正确;
B.同周期自左而右原子半径减小,故原子半径Mg>S>Cl,故B正确;
C.CCl4分子中C、Cl原子最外层均达到8电子结构,故C正确;
D.非金属性C<S<Cl,故最高价氧化物对应的水化物中酸性最强的是HClO4,故D错误,
故选D.
点评 本题考查位置结构性质关系应用,推断元素是解题关键,较好的考查学生的分析推理能力,难度中等.


科目:高中化学 来源: 题型:选择题
| R | ||
| X | T | Z |
| Q |
| A. | 非金属性:X<T<Z | B. | R和Q的电子数差为26 | ||
| C. | 气态氢化物稳定性:R<T<Z | D. | 最高价含氧酸酸性:T>Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图为化学教学中所用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )
如图为化学教学中所用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )| A. | CO2和NaOH溶液 | B. | O2和H2O | C. | NH3和H2O | D. | SO2和NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |
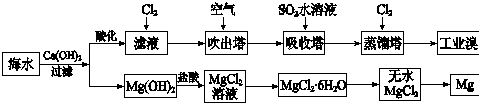
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl最高正化合价依次升高 | |
| C. | F-、Cl-、Br-还原性依次减弱 | |
| D. | Na、K、Rb的金属性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径逐渐减小 | B. | 最外层电子数逐渐增多 | ||
| C. | 最高正化合价逐渐增大 | D. | 元素的非金属性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在周期表中,原子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 室温时,零族元素的单质都是气体 | |
| D. | 位于 IA的元素与位于 VIIA的元素组成的化合物都是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产物中只有四氯化碳分子是正四面体结构 | |
| B. | 瓶中气体的黄绿色逐渐变浅,瓶内壁有油状液滴形成 | |
| C. | 若日光直射,可能发生爆炸 | |
| D. | 生成物只有CCl4、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无水乙酸和乙醇共热制取乙酸乙酯 | |
| B. | 用制取氢气的装置制取乙炔 | |
| C. | 将铜丝在酒精灯上加热后,立即伸人无水乙醇中,铜丝恢复原来的红色 | |
| D. | 淀粉用酸催化水解后的溶液加入新制银氨溶液,水浴加热,可看到有银镜出现 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com