
| A、HS-+H2O?S2++H2O+ |
| B、Fe3++3H2O?Fe(OH)3↓+3H+ |
| C、CO32-+2H2O?H2CO3+2OH- |
| D、NH4++H2O?NH3?H2O+H+ |


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
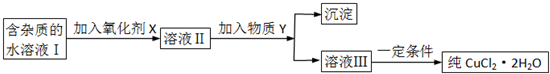
查看答案和解析>>
科目:高中化学 来源: 题型:
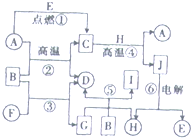 物质A~J之间的转化关系如图所示,其中A、F、H为常见的金属单质,D、E为常见的非金属气态单质,其余的为化合物,且单质E和单质F在点燃条件下可生成淡黄色固体,B在常温常压下为液态化合物.试回答下列问题:
物质A~J之间的转化关系如图所示,其中A、F、H为常见的金属单质,D、E为常见的非金属气态单质,其余的为化合物,且单质E和单质F在点燃条件下可生成淡黄色固体,B在常温常压下为液态化合物.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
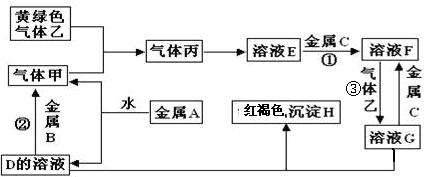
查看答案和解析>>
科目:高中化学 来源: 题型:
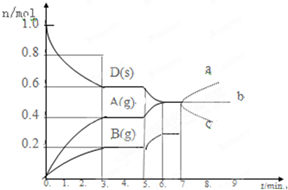
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大 |
| B、保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 |
| C、保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
| D、保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、υ(NH4)=0.8 mol/(L?s) |
| B、υ(O2)=1.0 mol/(L?s) |
| C、υ(NO)=1.0 mol/(L?s) |
| D、υ(H2O)=1.8 mol/(L?s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com