
| 选项 | 操作和现象 | 结 论 |
| A | 向盛有2mL 0.1mol/L AgNO3溶液的试管中,先滴几滴0.1mol/L KCl溶液,再滴加0.1mol/L KI溶液.试管中先出现白色沉淀,后出现淡黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 在分液漏斗中加入碘水后再加入CCl4,充分振荡,静置分层,下层溶液呈紫色 | CCl4可作为碘的萃取剂 |
| C | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| D | 测定饱和NaClO溶液、CH3COONa溶液的pH,pH(NaClO)>pH(CH3COONa) | 弱酸的酸性: HClO>CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
分析 A.白色沉淀转化成淡黄色沉淀,说明碘化银更难溶,则Ksp(AgCl)>Ksp(AgI);
B.碘单质易溶于四氯化碳,四氯化碳密度大于水;
C.酸性条件下Fe2+与NO3-发生氧化还原反应;
D.饱和NaClO溶液、CH3COONa溶液的浓度不同,无法据此判断醋酸和次氯酸的酸性.
解答 解:A.白色沉淀转化为黄色沉淀,说明生成AgI,生成物溶度积更小,则Ksp(AgCl)>Ksp(AgI),故A错误;
B.碘单质易溶于四氯化碳,四氯化碳不溶于水,可用四氯化碳萃取碘水中的碘单质,故B正确;
C.酸性条件下Fe2+与NO3-发生氧化还原反应,溶液颜色基本不变是由于Fe3+的浓度较小的原因,故C错误;
D.饱和NaClO溶液、CH3COONa溶液的浓度不同,应比较相同浓度的两溶液的pH,故D错误;
故选B.
点评 本题考查较为综合,涉及沉淀转化、物质分离与提纯方法、盐类的水解原理及其应用等知识,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,题目难度中等.


科目:高中化学 来源: 题型:实验题
| 编号 | ① | ② | ③ | ④ |
| 装置 |  |  | 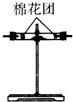 |  |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

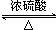 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④⑦ | C. | ③⑥ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| ① | ||||||||
| ② | ③ | |||||||
| ④ | ⑤ | ⑥ | ||||||
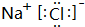 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蚕丝、羊毛、棉麻的主要成分都是蛋白质 | |
| B. | 淀粉、纤维素、油脂和蛋白质都属于天然高分子化合物 | |
| C. | 用甘氨酸和丙氨酸缩合最多可以形成4种二肽 | |
| D. | 蔗糖水解前后均可以发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
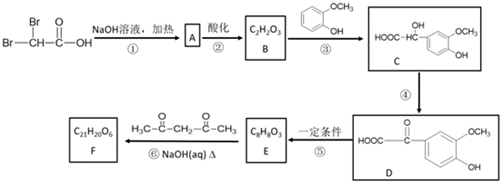
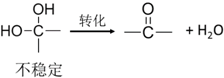

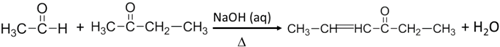
 .反应④的化学方程式是
.反应④的化学方程式是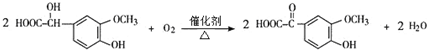 .
.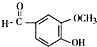 .F的结构简式是
.F的结构简式是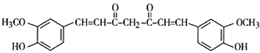 .
.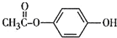 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
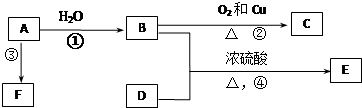
 ,该反应类型是取代反应.
,该反应类型是取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
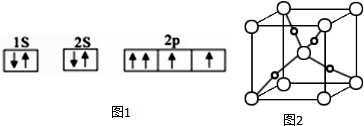
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com