
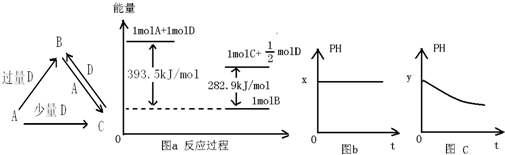
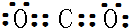 ����̼������ˮ���Լ��ԣ���ͼb��x��7��
����̼������ˮ���Լ��ԣ���ͼb��x��7�� ������
������| 1 |
| 2 |
| 1 |
| 2 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
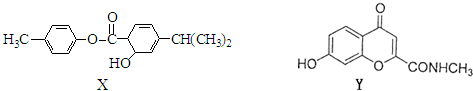
| A��1mol X��NaOH��Һ��Ӧ���������2 mol NaOH |
| B��X��Y���н�ǿ��ˮ���� |
| C��X��Y����ʹKMnO4��Һ��ɫ |
| D��X��Y��ˮ������п��ܷ����ۺϷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ع��͡������ӹ��������������Ʒ������������ |
| B����ˮ�����ܽ����ˮ��ӦΣ������ˮ�мӾ�ˮ����������ʹ��ˮ���� |
| C�������ڳ�ʪ�Ŀ����������⣬�为����ӦʽΪ��2H2O+O2+4e-=4OH- |
| D��BaSO4��ҽѧ���������ͣ�Ba2+�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��5.6g��������������ȼ�գ�����ת��0.3NA�� |
| B����״���£�2.24Lˮ�к���0.1NA��ˮ���� |
| C��1.12L�����з�Ӧ0.1NA����ԭ�� |
| D��12gʯī��C60�Ļ�Ϲ����У���̼ԭ��NA�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
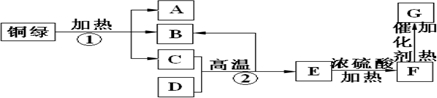
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ����NaOH��Һ����� | pH | |
| �� | 0L | 2 |
| �� | 1L | 4 |
| �� | 2L | 10 |
| �� | 3L | 12 |
| c(Na+) | ||
c(P
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����һ�������£����ֽ�80g SO3�������������ԭ����Ϊ3��6.02��1023 |
| B��һ�������£�����ˮ������Ӧ����8.96L H2ʱ�����ۺϳɱ������ת�Ƶĵ�����Ϊ0.8��6.02��1023 |
| C��100mL 1mol/L AlCl3��3mol/L NaCl�Ļ����Һ�У�Cl-�ĸ���Ϊ0.6��6.02��1023 |
| D�����зǼ��Լ�����ĿΪ6.02��1023��Na2O2��ˮ��ַ�Ӧ������²���O2 22.4L |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com