
在某温度下,可逆反应mA+nB⇌pC+qD平衡常数为K,下列说法正确的是( )
|
| A. | K越大,达到平衡时,反应进行的程度越大 |
|
| B. | K越小,达到平衡时,反应物的转化率越大 |
|
| C. | K随反应物浓度的改变而改变 |
|
| D. | K随着温度的升高而增小 |
考点:
化学平衡常数的含义.
专题:
化学平衡专题.
分析:
A、平衡常数越大,说明反应进行的程度越大;
B、平衡常数越小,反应进行的程度越小,反应物的转化率越小;
C、化学平衡常数只受温度影响;
D、温度对化学平衡常数的影响与反应的热效应有关,根据热效应判断温度升高平衡移动方向,据此判断升高温度对化学平衡常数的影响.
解答:
解:A、平衡常数越大,说明反应进行的程度越大,故A正确;
B、平衡常数越小,反应进行的程度越小,反应物的转化率越小,故B错误;
C、化学平衡常数只受温度影响,与浓度无关,温度不变化学平衡常数不变,故C错误;
D、若该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡常数降低,若正反应为吸热反应,升高温度平衡向正反应移动,平衡常数增大,故D错误;
故选A.
点评:
本题考查化学平衡常数的意义、影响化学平衡常数的因素等,比较基础,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:
)磷酸燃料电池是目前较为成熟的燃料电池,其基本组成和反应原理如下。
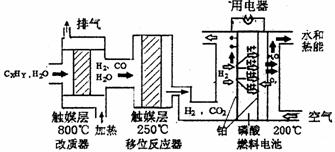
(1)在改质器中主要发生的反应为_______________________________
(2)移位反应器中CO(g)+H2O (g) 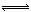 CO2 (g)+H2(g) ,在一定温度下,在1L容器中发生上述反应,各物质的物质的量浓度变化如下表:
CO2 (g)+H2(g) ,在一定温度下,在1L容器中发生上述反应,各物质的物质的量浓度变化如下表:
| t/min | COmol/L) | H2O(mol/L) | CO2(mol/L) | H2(mol/L) |
| 0 | 0.2 | 0.3 | 0 | 0 |
| 2 | n1 | n2 | n3 | 0.1 |
| 3 | n1 | n2 | n3 | 0.1 |
| 4 | 0.09 | 0.19 | 0.11 | 0.11 |
①此温度下,该反应的平衡常数为________
②反应在3~4 min之间,氢气的物质的量增多的原因可能是 (填代号)
A.充入水蒸汽 B.升高温度 C.使用催化剂 D.充入氢气
(3)磷酸燃料电池负极排出的气体主要是___ __,
该电池正极的电极反应为_ _ __。
(4)磷酸燃料电池的电极上镀了铂粉,这样做的目的,除了起到更好的导电作用外,还具备的作用是 。
(5)总体看来,整个体系中能量来自与CxHy与空气的反应,假设CxHy为辛烷,且
已知辛烷的燃烧热为5 518 kJ·mol-1,请写出辛烷燃烧热的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
有关该电池的说法不正确的是 ( )
A.放电时化学能不能全部转化为电能
B.放电时Cd为该电池的负极,充电时这一端应接直流电源的正极
C.放电时该电池的正极反应为:NiOOH+H2O+e-===Ni(OH)2+OH-
D.充电时,阴极反应为:Cd(OH)2+2e-===Cd+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.常温时下列有关说法正确的是 ( )
A.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强
B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L
C.因为H2SO4是强酸,所以反应:CuSO4+H2S===CuS↓+H2SO4不能发生
D.除去工业废水中的Cu2+可以选用FeS作沉淀剂
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应mX(g)+nY(g)⇌qZ(g);△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
|
| A. | 通入稀有气体使压强增大,平衡将正向移动 |
|
| B. | X的正反应速率是Y的逆反应速率的 |
|
| C. | 降低温度,混合气体的平均相对分子质量变小 |
|
| D. | 若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n:m |
查看答案和解析>>
科目:高中化学 来源: 题型:
在温度压强不变时,1mol NO2高温分解,生成NO和O2,达到平衡时容器内气体的物质的量变为1.2mol,这时NO2的转化率为( )
|
| A. | 10% | B. | 20% | C. | 40% | D. | 50% |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列三个数据:①7.2×10﹣4、②2.6×10﹣4、③4.9×10﹣10分别是三种酸的电离平衡常数,若已知这些酸可以发生如下反应:NaCN+HNO2=HCN+NaNO2 NaCN+HF=HCN+NaF NaNO2+HF=HNO2+NaF 由此可判断下列叙述中正确的是( )
|
| A. | HNO2的电离平衡常数是③ | B. | HNO2的电离平衡常数是① |
|
| C. | HCN的电离平衡常数是② | D. | HF的电离平衡常数是① |
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.001 mol·L-1 KMnO4酸性溶液滴定未知浓度的无色NaHSO3溶液。反应离子方程式是2MnO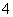 +5HSO
+5HSO +H+===2Mn2++5SO
+H+===2Mn2++5SO +3H2O
+3H2O
填空完成问题:
(1)该滴定实验所需仪器有下列中的____________。
A.酸式滴定管(50 mL) B.碱式滴定管(50 mL)
C.量筒(10 mL) D.锥形瓶 E.铁架台 F.滴定管夹
G.烧杯 H.白纸 I.胶头滴管 J.漏斗
(2)不能用______(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因__________
_________________________________________________________________。
(3)选何种指示剂,说明理由_________________________________________。
(4)滴定前平视KMnO4溶液液面,刻度为a mL,滴定后俯视液面刻度为b mL,则(b-a)mL比实际消耗KMnO4溶液体积________(填“多”或“少”)。根据(b-a)mL计算得到的待测浓度,比实际浓度________(填“大”或“小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com