
| 条件的变化 | 通氨气 | 加水 | 加NH4Cl(s) | |
| ① | 电离平衡移动的方向 | |||
| ② | c(OH-)的变化 |
| 条件的变化 | 通氨气 | 加水 | 加NH4Cl(s) |
| 电离平衡移动的方向 | 向右 | 向右 | 向左 |
| c(OH-)的变化 | 增大 | 减小 | 减小 |


科目:高中化学 来源: 题型:
| A、反应后溶液中无硝酸亚铁 |
| B、反应前HNO3溶液的浓度为2.0mol?L-1 |
| C、反应后溶液中c(NO3-)=1.6mol?L-1 |
| D、反应后的溶液最多还能溶解1.61g Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
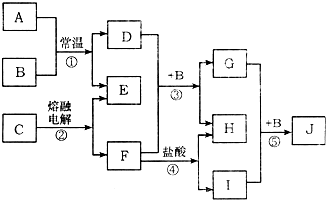
查看答案和解析>>
科目:高中化学 来源: 题型:
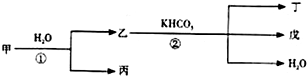 甲、乙、丙、丁、戊几种中学常见的物质在常温有如图转化关系,在转化过程中,乙与KHCO3按等物质的量混合,并且恰好完全反应.
甲、乙、丙、丁、戊几种中学常见的物质在常温有如图转化关系,在转化过程中,乙与KHCO3按等物质的量混合,并且恰好完全反应.查看答案和解析>>
科目:高中化学 来源: 题型:
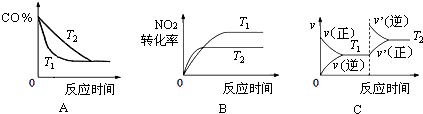
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
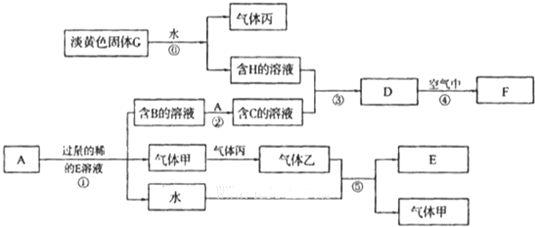
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气的体积为1.12L |
| B、原烧碱溶液中含溶质离子0.2NA |
| C、所得溶液中含OH-的数目为1×10-5NA |
| D、所得溶液中C1O-的数目为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、两个反应均为氧化还原反应 |
| B、CO2与SO2可以用澄清石灰水鉴别 |
| C、CO2分子中各原子最外层均为8电子稳定结构 |
| D、相同条件下:2CO(g)+SO2(g)═S(g)+2CO2(g)△H=-270kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com