
 .
.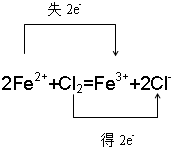 .
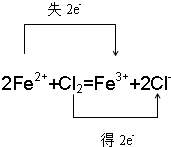
.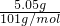 =0.05mol,由2Fe2++Cl2=Fe3++2Cl-可知,0.09mol Cl2能氧化Fe2+为2×0.09mol=0.18mol,所以NO3-氧化的Fe2+为0.33mol-0.18mol=0.15mol,令N元素在还原产物中的化合价为x,根据电子转移有0.05mol×(5-x)=0.15mol×(3-2),解得x=2.
=0.05mol,由2Fe2++Cl2=Fe3++2Cl-可知,0.09mol Cl2能氧化Fe2+为2×0.09mol=0.18mol,所以NO3-氧化的Fe2+为0.33mol-0.18mol=0.15mol,令N元素在还原产物中的化合价为x,根据电子转移有0.05mol×(5-x)=0.15mol×(3-2),解得x=2.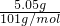 =0.05mol,由2Fe2++Cl2=Fe3++2Cl-可知,0.09mol Cl2能氧化Fe2+为2×0.09mol=0.18mol,所以NO3-氧化的Fe2+为0.33mol-0.18mol=0.15mol,根据电子转移计算KNO3被还原后氮的化合价.
=0.05mol,由2Fe2++Cl2=Fe3++2Cl-可知,0.09mol Cl2能氧化Fe2+为2×0.09mol=0.18mol,所以NO3-氧化的Fe2+为0.33mol-0.18mol=0.15mol,根据电子转移计算KNO3被还原后氮的化合价.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将1.01g KNO3溶于100mL水配制而成 |
| B.将5.05g KNO3溶于水配制成500mL水溶液 |
| C.将100mL 0.2 mol?L-1 KNO3溶液加水稀释成200mL |
| D.将10.1g KNO3溶于水配制成1L水溶液 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省潍坊一中高一(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com