
【题目】用pH传感器测得0.10 mol·L-1Na2CO3溶液从55 ℃升高至85 ℃的pH如图所示。在升温过程中,下列说法正确的是( )
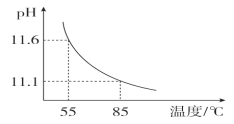
A.c(H+)增大,c(OH-)减小
B. ![]() 的比值不断增大
的比值不断增大
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.10 mol·L-1
D.85 ℃时,c(OH-)-c(HCO3-)-c(H2CO3)=10-11.1 mol·L-1
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】为探究一溴环己烷(![]() )与NaOH 的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计了如下三种实验方案。
)与NaOH 的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计了如下三种实验方案。
甲:向反应混合液中滴入稀硝酸中和NaOH 溶液,然后滴入AgNO3溶液,若有淡黄色沉淀生成,则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性FeCl3溶液,若溶液颜色变为紫色,则可证明发生了水解反应。
其中正确的是( )
A.甲B.乙
C.丙D.上述实验方案都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的微粒浓度关系不正确的是
A. pH=8.3的某酸式盐NaHB的水溶液中:c (Na+) > c (HB-) > c (H2B) > c (B2-)
B. 等物质的量浓度的Na2S和NaHS溶液中:c (Na+)=2c (S2-) + c (HS-)
C. NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c (Na+) > c (SO42-) > c (NH4+) > c (OH-)=c (H+)
D. 0.1 mol / L NaH2PO4溶液中:c (Na+)=c (PO43-) + c (HPO42-) + c (H2PO4-) + c (H3PO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究乙醇和金属钠反应生成![]() 的原理,某同学做了如下四个实验。
的原理,某同学做了如下四个实验。
甲:向小烧杯中加入无水乙醇,再放入一小块金属钠,观察现象,并收集产生的气体
乙:设法检验甲收集到的气体。
丙:向试管中加人![]() 水,并加入绿豆粒大小的金属钠,观察现象。
水,并加入绿豆粒大小的金属钠,观察现象。
丁:向试管中加人![]() 乙醚(
乙醚(![]() ),并加入绿豆粒大小的金属钠,发现无明显变化。
),并加入绿豆粒大小的金属钠,发现无明显变化。
回答以下问题:
(1)从结构上分析,该实验选取水和乙醚作参照物的原因是__________。
(2)丙的目的是证明_____________;丁的目的是证明_______;根据丙和丁的结果,可以得出乙醇和金属钠反应的化学方程式应为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20.00mL0.1mol·L-1H2X溶液中滴入0.1mol·L-1 NaOH溶液,溶液中由水电离出的c水(OH-)的负对数[-1gc水(OH-)]与所加NaOH溶液体积的关系如图所示。
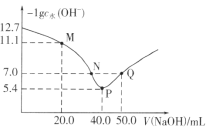
下列说法中正确的是
A. 水的电离程度:M>N=Q>P
B. 图中M、P、Q三点对应溶液中![]() 相等
相等
C. N点溶液中c(Na+)>c(X2-)>c(HX-)>c(H+)=c(OH-)
D. P点溶液中c(OH-)=c(H+)+c(HX-)+c(H2X)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作及现象推出的结论正确的是
| 实验操作 | 实验现象 | 实验结论 |
A. | 向某溶液中滴加少量氯水,再滴加淀粉溶液 | 溶液变为蓝色 | 则原溶液中一定含 |
B. | 向某盐溶液中滴加浓盐酸,将产生的气体通入品红溶液中 | 品红溶液褪色 | 该盐一定是亚硫酸盐或亚硫酸氢盐 |
C. | 将浓盐酸与石灰石混合,产生的气体通入 | 出现白色沉淀 | C的非金属性比Si强 |
D. | 加热涂有石蜡油的碎瓷片,将生成的气体通入酸性 |
| 石蜡油分解产生不饱和烃 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断正确的是
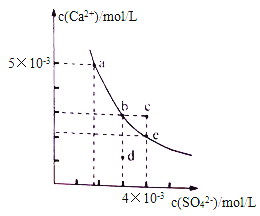
A. 曲线上任意一点的Ksp都相同
B. 在CaSO4饱和溶液中加入Na2SO4固体,可使溶液由b点变化到c点
C. 蒸发水后,可使溶液由d点变化到b点
D. 常温下,CaSO4的Ksp的数量级为10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。在一定温度下,用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的盐酸和醋酸溶液,滴定曲线如图所示。下列有关判断正确的是
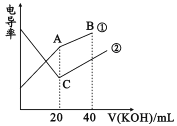
A. B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+)
B. A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.1mol/L
C. C点水电离的c(OH-)大于A点水电离的c(OH-)
D. A、B、C三点溶液均有Kw=c(H+)·c(OH-)=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向25℃时,体积均为20mL浓度均为0.1mol·L-1的两种酸HX、HY溶液中分別滴加0.1mol·L-1的NaOH溶液所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是
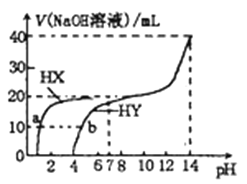
A. HX、HY均为弱酸
B. Ka(HY)的数量级约为10-6
C. b点时:2c(Na+)=c(Y-)+c(HY)
D. V(NaOH)=20mL时,反应后的两种溶液中c(X-)=c(Y-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com