
| A. | 正极反应为H2-2e-=2H+ | |
| B. | 在电池工作时,H+移向负极 | |
| C. | 电池正极发生氧化反应 | |
| D. | 以盐酸作为电解质溶液,并不断补充蒸馏水,以维持溶液一定的pH |
分析 根据总反应H2+Cl2=2HCl可知氢气发生氧化反应,氯气发生还原反应,原电池的负极失去电子发生氧化反应,正极得电子发生还原反应,在电解质溶液中,阳离子移向正极,阴离子移向负极,据此解答.
解答 解:A.负极应是氢气失去电子发生氧化反应,电极反应式为:H2-2e-=2H+,正极是氯气得到电子发生还原反应,电极反应式为:Cl2+2e-=2Cl-,故A错误;
B.在电池工作时,阳离子有得电子趋向,所以H+移向正极,故B错误;
C.原电池正极发生还原反应; 故C错误;
D.根据总反应H2+Cl2=2HCl可知电池工作时生成了更多的HCl,以盐酸作为电解质溶液,溶质增加,其他条件不变,溶液的浓度会增加,酸性会增强,所以要维持溶液一定的pH,就要不断补充蒸馏水,故D正确;
故选D.
点评 本题考查了原电池的设计,熟悉原电池的工作原理是解题的关键,要求学生有运用知识的能力,题目难度适中.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:解答题
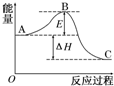 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99 kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99 kJ•mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀盐酸反应:Fe+2H+=Fe2++H2↑ | |
| B. | 氨水与盐酸反应:OH-+H+=H2O | |
| C. | 锌与硫酸铜溶液反应:Zn+Cu2+=Zn2++Cu | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
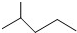 表示的分子式是C6H14;名称是2-甲基戊烷.
表示的分子式是C6H14;名称是2-甲基戊烷.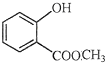 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.067mol | B. | 0.02mol | C. | 0.03mol | D. | 0.04mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸分子中含有的官能团是羧基(-COOH) | |
| B. | 乙酸俗称酒精 | |
| C. | 乙酸与苏打(碳酸钠)作用会有气泡产生 | |
| D. | 在发生酯化反应时,乙酸分子中的羟基跟醇分子中羟基上的氢原子结合成水分子 |
查看答案和解析>>
科目:高中化学 来源:2017届河南省开封市高三上学期10月定位考试化学试卷(解析版) 题型:选择题
K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O 2 CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
2 CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
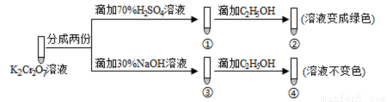
结合实验,下列说法正确的是
A.①中溶液变黄,③中溶液橙色加深
B.②中Cr2O72-被C2H5OH氧化
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com