
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| C. | 萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴 | |
| D. | 蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸 |
分析 A.蒸发时利用余热加热;
B.分液时避免上下层液体混合;
C.酒精与水互溶,不能作萃取剂;
D.沸石可防止液体剧烈沸腾.
解答 解:A.蒸发时利用余热加热,则蒸发时不能蒸干,故A错误;
B.分液时避免上下层液体混合,则先将分液漏斗中下层液体从下口放出,再将上层液体从上口放出,故B错误;
C.酒精与水互溶,不能作萃取剂,则选用CCl4作为萃取剂从溴水中萃取溴,故C错误;
D.沸石可防止液体剧烈沸腾,则蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、实验基本操作为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:解答题
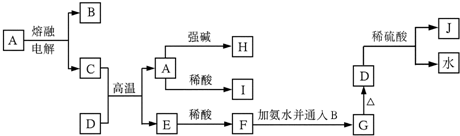
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1 | B. | 0.4 mol•L-1 | C. | 0.6 mol•L-1 | D. | 0.8 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
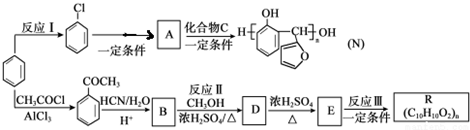
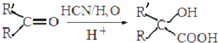
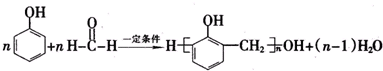
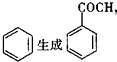 的反应类型是取代反应,D生成E的过程中,浓硫酸的作用是催化剂和脱水剂•
的反应类型是取代反应,D生成E的过程中,浓硫酸的作用是催化剂和脱水剂•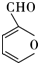
 .
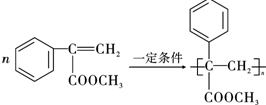
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
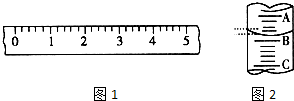 (1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在下表中填空,表示称量过程,并在图1所示的游码尺上画出游码的位置(画“|”表示).
(1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在下表中填空,表示称量过程,并在图1所示的游码尺上画出游码的位置(画“|”表示).| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.025 mol | B. | 0.050 mol | C. | 0.100 mol | D. | 0.200 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com