
【题目】某矿样含有大量的CuS及少量其它不溶于酸的杂质。实验室中以该矿样为原料制备CuCl2·2H2O晶体,流程如下:

(1)在实验室中,欲用37%(密度为1.19 g·mL-1)的盐酸配制500 mL 6mol·L-1的盐酸,需要的仪器除量筒、烧杯、玻璃棒外,还有__________________、__________________。
(2)①若在实验室中完成系列操作a。则下列实验操作中,不需要的是___________(填下列各项中序号)。
②CuCl2溶液中存在如下平衡: ![]() 欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中,还需要的是 _________(填下列各项中序号)。
欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中,还需要的是 _________(填下列各项中序号)。
a.FeCl3固体 b.CuCl2固体 c.蒸馏水
(3)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气条件下焙烧 CuS时,固体质量变化曲线及SO2生成曲线如下图所示。
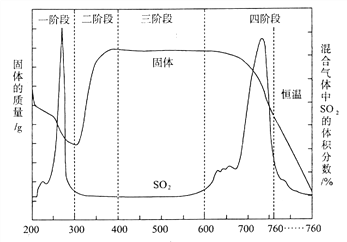
① CuS矿样在焙烧过程中,有![]() 生成,转化顺序为:
生成,转化顺序为:
![]()
第①步转化主要在200~300℃范围内进行,该步转化的化学方程式为________________________。
② 300~400℃范围内,固体质量明显增加的原因是__________________________,上图所示过程中,CuSO4固体能稳定存在的阶段是_________________(填下列各项中序号)。
a.一阶段 b.二阶段 c.三阶段 d.四阶段
③ 该化学小组设计如下装置模拟CuS矿样在氧气中焙烧第四阶段的过程,并验证所得气体为SO2和O2的混合物。
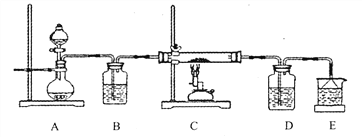
a.装置组装完成后,应立即进行的一项操作是___________________________。
b.当D装置中产生白色沉淀时,便能说明第四阶段所得气体为SO2和O2的混合物,你认为装置D中原来盛有的溶液为______________溶液。
【答案】 胶头滴管 500mL容量瓶 c d c 2CuS+O2=Cu2S+SO2 Cu2S转化为CuSO4 c a. 检验装置的气密性 b.氯化钡(BaCl2)
【解析】(1)由浓盐酸配制稀盐酸,需要的仪器除量筒、烧杯、玻璃棒外,还需要:胶头滴管、500mL容量瓶。(2)①由CuCl2溶液制取CuCl22H2O,需要进行蒸发浓缩、降温结晶,然后过滤可得CuCl22H2O晶体,所以不需要c、d操作。②FeCl3溶液为黄色,CuCl2溶液为蓝色,对原平衡体系溶液的颜色产生干扰,而加入蒸馏水可使平衡向逆反应方向移动,溶液的颜色发生改变,可证明滤液A(绿色)中存在上述平衡,故c项正确。(3)①根据流程图CuS与O2反应生成Cu2S,还应生成SO2,化学方程式为:2CuS+O2=Cu2S+SO2。②第②步转化,由Cu2S转化为CuOCuSO4,所以300~400oC范围内,固体质量明显增加的原因是Cu2S转化为CuSO4;第二阶段生成了CuSO4,第四阶段固体质量减小,CuSO4发生了分解反应,所以CuSO4固体能稳定存在的阶段是第三阶段,答案选c。③a.实验装置组装完后应首先检验装置的气密性;b. SO2与BaCl2不反应,SO2、O2与BaCl2溶液反应可以生成BaSO4沉淀,所以装置D中原来盛有的溶液为BaCl2溶液。


科目:高中化学 来源: 题型:
【题目】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期。自然界存在多种A的化合物,B原子核外电子由6种不同的运动状态,B与C可形成正四面体形分子,D的M能层没有空轨道且只有2个未成对电子。请回答下列问题:
(1)A与B元素形成的B2A2种含有的σ键、π键数目之比为________。
(2)B元素的一种单质晶体结构如图1所示,理论上12g该晶体中有________个六元环;图2位在元素周期表中与B相邻的元素位置关系,B、G形成的晶胞结构如图3所示(其中“●”为B元素原子,“〇”为G元素原子),图中“●”点构成的堆积方式与图4中_____(填序号)所表示的堆积方式相同;图3的结构中,设晶胞边长为a cm,B原子直径为bcm,G原子直径为c cm,则该晶胞的空间利用率为_______(用含a、b、c的式子表示)。

(3)请说出E的氟化物(EF3)和F的氢化物(FH3)能发生反应的原因,并写出反应的化学方程式_____(用化学式表示)。
(4)元素C的含氧酸中,酸性最强的是_________(写化学式),该酸根离子的立体构型为________。
(5)基态D原子的核外电子排布式为[Ar]_______;D形成的配合物D(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=______;由D一铝合金为原料可制得一种历史悠久、应用广泛的催化剂,其催化的i实例为: 化合物b中进行sp3杂化的原子有__________(填元素符号)。
化合物b中进行sp3杂化的原子有__________(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国药学家屠呦呦因发现植物黄花蒿叶中含有抗疟疾的物质—青蒿素而荣获2015年诺贝尔奖。科学家对青蒿素的结构进行进一步改良,合成药效更佳的双氢青蒿素、蒿甲醚。下列说法正确的是
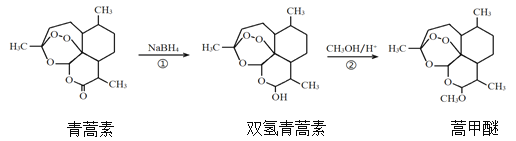
A.利用黄花蒿叶研究青蒿素结构的基本步骤为:元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式
B.①、②的反应类型分别为还原反应、酯化反应
C.双氢青蒿素在水中的溶解性大于青蒿素
D.双氢青蒿素与蒿甲醚组成上相差-CH2-,二者互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨主要用于生产化肥和硝酸。“十三五”期间,预计我国合成氨产量将保持稳中略增。
(1)目前工业上用氮气和氢气合成氨的生产条件为_________。
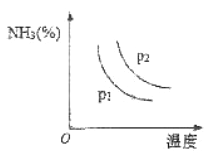
(2)下图是不同温度和不同压强下,反应达到平衡后,混合物中NH3含量(体积%)的变化情况,己知初始时n(N2):n(H2)=1:3。由图可知,合成氨的反应是______反应(选填“吸热”、“放热”);判断pl、p2压强的大小关系,pl_______p2 (选填“>”、 “<”或“=”)。
(3)草木灰主要含有碳酸钾,解释草木灰不宜与铵态氮肥混合使用的原因_____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5 mol H2O的质量为 ____,其中含有_____个水分子,共有____个原子。
(2)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是______,在相同温度和相同压强条件下,体积最大的是______,体积最小的是________。
(3)在_______mL 0.2 mol/L NaOH溶液中含1 g溶质;配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O _________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于烷烃的叙述不正确的是( )
A. 烷烃中每个碳原子都形成4个共价单键
B. 正丁烷的4个碳原子可以在同一直线上
C. 甲烷、乙烷、丙烷的结构都只有一种
D. 任何烷烃分子不可能为平面结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法中正确的是( )
A. 凡是含有碳元素的化合物都属于有机物
B. 易溶于有机溶剂的物质一定是有机物
C. 所有有机物都很容易燃烧
D. 有机物组成元素不多,但其数量众多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 按系统命名法,化合物![]() 的名称是2,3,5,5-四甲基-4,4-二乙基己烷
的名称是2,3,5,5-四甲基-4,4-二乙基己烷
B. 淀粉、纤维素互为同分异构体
C. 某烃![]() 分子中至少有11个碳原子处于同一平面
分子中至少有11个碳原子处于同一平面
D. ![]() 与苯酚是同系物
与苯酚是同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com