
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ | |||||||
| 电离能I(eV) | A | B | C | D | E |
| I1 | 11.3 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 113.9 | 138.3 | 141.3 | 153.7 |
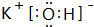 ,
,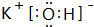 ;
;

科目:高中化学 来源: 题型:
| A、溶质的质量增大 |
| B、溶质的物质的量浓度增大 |
| C、Ca(OH)2浓度不变 |
| D、溶质的质量分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、塑料袋在全球“失宠”,是因为塑料袋填埋占用土地,且难以降解 |
| B、举行“地球一小时”熄灯活动,会影响经济发展及社会生活,所以不宜推广 |
| C、有色玻璃是某些胶态金属分散于玻璃中制成的胶体 |
| D、太阳能是目前人类生产生活直接利用的、转化效率最高的能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| A | ||||||
| D | E | F | H | |||
| C | B | G |
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ||||||||
| 3 | ① | ② | ||||||
| 4 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 5 | ⑩ | ? | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 |
| B、乙烯能发生加成反应,而乙烷不能发生加成反应 |
| C、苯与硝酸在加热的条件下发生取代反应,而甲苯在常温下就能与硝酸发生反应 |
| D、2-甲基-1-丙烯与溴的CCl4溶液加成速率比乙烯与溴的CCl4溶液加成速率快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com