
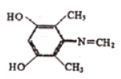
°æƒø°øªØ∫œŒÔH «∫œ≥…“ª÷÷“©ŒÔµƒ÷–º‰Ã£¨ø…Õ®π˝“‘œ¬∑Ω∑®∫œ≥…£∫
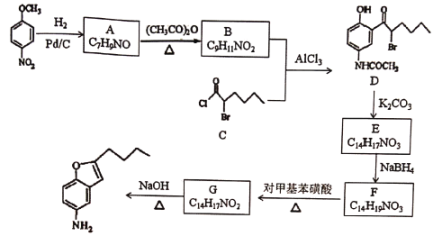
“—÷™£∫¢Ÿ ¢⁄
¢⁄
£®1£©ªØ∫œŒÔFµƒΩ·ππºÚ Ω_____°£
£®2£©œ¬¡–Àµ∑®’˝»∑µƒ «_____°£
A. ”…∑¥”¶ŒÔ◊™ªØŒ™A£¨E◊™ªØŒ™Fæ˘∑¢…˙¡Àªπ‘≠∑¥”¶
B. ªØ∫œŒÔF÷–”–2∏ˆ ÷–‘ú‘≠◊”
C. 1molGƒÐ”Î5molH2∑¢…˙º”≥…∑¥”¶
D.ªØ∫œŒÔHµƒ∑÷◊” ΩŒ™C12H15NO
£®3£©–¥≥ˆD°˙EµƒªØ—ß∑Ω≥à Ω______°£
£®4£©«Î–¥≥ˆ“‘’˝º∫¥ºŒ™‘≠¡œ÷∆±∏ªØ∫œŒÔCµƒ¡˜≥ÃÕº£¨ŒÞª˙ ‘º¡»Œ—°°£________________
£®5£©–¥≥ˆÕ¨ ±¬˙◊„œ¬¡–Ãıº˛µƒBµƒÀ˘”–Õ¨∑÷“ÏππõƒΩ·ππºÚ Ω______°£¢Ÿ∑÷◊”÷–÷ª”–4÷÷≤ªÕ¨ªØ—ߪ∑æ≥µƒ«‚¢⁄∑÷◊”÷–≤ª∫¨µ™—ıº¸°¢C=O¢€∑÷◊”÷–÷ª”–“ª∏ˆª∑◊¥Ω·π𣨫“”ˆFeCl3»Ð“∫œ‘◊œ…´
°æ¥∞∏°ø ABD
ABD  ªÚ
ªÚ
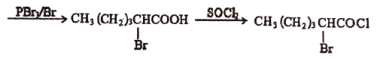

°æΩ‚Œˆ°ø
”…D∫ÕC£®![]() £©µƒΩ·ππø…÷™BŒ™
£©µƒΩ·ππø…÷™BŒ™![]() £¨ƒ«√¥AŒ™
£¨ƒ«√¥AŒ™![]() £¨D£®
£¨D£®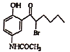 £©”ÎK2CO3∑¥”¶…˙≥…E£¨”…Eµƒ∑÷◊” Ω÷™D ß»•“ª∑÷◊”HBr…˙≥…E£¨E∑¢…˙“—÷™µƒ∑¥”¶¢Ÿ£¨Àµ√˜F÷–∫¨”–Ù«ª˘£¨∂‘±»D”Î◊Ó÷’µƒ≤˙ŒÔ£¨ø…µ√D◊™ªØŒ™E ± ß»•“ª∑÷◊”HBr–Œ≥…ª∑◊¥ŒÔ÷ £¨ƒ«√¥EŒ™
£©”ÎK2CO3∑¥”¶…˙≥…E£¨”…Eµƒ∑÷◊” Ω÷™D ß»•“ª∑÷◊”HBr…˙≥…E£¨E∑¢…˙“—÷™µƒ∑¥”¶¢Ÿ£¨Àµ√˜F÷–∫¨”–Ù«ª˘£¨∂‘±»D”Î◊Ó÷’µƒ≤˙ŒÔ£¨ø…µ√D◊™ªØŒ™E ± ß»•“ª∑÷◊”HBr–Œ≥…ª∑◊¥ŒÔ÷ £¨ƒ«√¥EŒ™ £¨FŒ™
£¨FŒ™ £¨GŒ™
£¨GŒ™ £¨æð¥À≈–∂œ¥∞∏°£
£¨æð¥À≈–∂œ¥∞∏°£
”…D∫ÕC£®![]() £©µƒΩ·ππø…÷™BŒ™
£©µƒΩ·ππø…÷™BŒ™![]() £¨ƒ«√¥AŒ™
£¨ƒ«√¥AŒ™![]() £¨D£®
£¨D£® £©”ÎK2CO3∑¥”¶…˙≥…E£¨”…Eµƒ∑÷◊” Ω÷™D ß»•“ª∑÷◊”HBr…˙≥…E£¨E∑¢…˙“—÷™µƒ∑¥”¶¢Ÿ£¨Àµ√˜F÷–∫¨”–Ù«ª˘£¨∂‘±»D”Î◊Ó÷’µƒ≤˙ŒÔ£¨ø…µ√D◊™ªØŒ™E ± ß»•“ª∑÷◊”HBr–Œ≥…ª∑◊¥ŒÔ÷ £¨ƒ«√¥EŒ™
£©”ÎK2CO3∑¥”¶…˙≥…E£¨”…Eµƒ∑÷◊” Ω÷™D ß»•“ª∑÷◊”HBr…˙≥…E£¨E∑¢…˙“—÷™µƒ∑¥”¶¢Ÿ£¨Àµ√˜F÷–∫¨”–Ù«ª˘£¨∂‘±»D”Î◊Ó÷’µƒ≤˙ŒÔ£¨ø…µ√D◊™ªØŒ™E ± ß»•“ª∑÷◊”HBr–Œ≥…ª∑◊¥ŒÔ÷ £¨ƒ«√¥EŒ™ £¨FŒ™
£¨FŒ™ £¨GŒ™
£¨GŒ™ £ª
£ª
£®1£©”…∑÷Œˆ÷™FŒ™ £ª
£ª
£®2£©A. ∑¥”¶ŒÔ◊™ªØŒ™A£¨∑¢…˙¡Àªπ‘≠∑¥”¶£¨E◊™ªØŒ™F“≤∑¢…˙¡Àªπ‘≠∑¥”¶£¨AœÓ’˝»∑£ª
B. FŒ™ £¨Ω·ππ÷–∫¨”–2∏ˆ ÷–‘ú‘≠◊”£¨BœÓ’˝»∑£ª
£¨Ω·ππ÷–∫¨”–2∏ˆ ÷–‘ú‘≠◊”£¨BœÓ’˝»∑£ª
C. GŒ™ £¨1molG÷ªƒÐ”Î4molH2∑¢…˙º”≥…∑¥”¶£¨CœÓ¥ÌŒÛ£ª
£¨1molG÷ªƒÐ”Î4molH2∑¢…˙º”≥…∑¥”¶£¨CœÓ¥ÌŒÛ£ª
D.◊Ó÷’µƒ≤˙ŒÔŒ™H£¨∑÷◊” ΩŒ™C12H15NO£¨DœÓ’˝»∑£ª
¥∞∏—°ABD°£
£®3£©D°˙E∑¢…˙µƒ∑¥”¶Œ™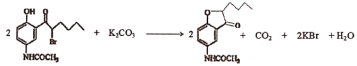 £ª
£ª
£®4£©’˝∂°¥º—ıªØŒ™’˝∂°»©£¨‘Ÿ—ıªØµ√µΩ’˝∂°À·£¨∏˘æð∑¥”¶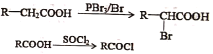 º¥ø…µ√µΩ≤˙ŒÔ£¨¡˜≥ÃÕºŒ™
º¥ø…µ√µΩ≤˙ŒÔ£¨¡˜≥ÃÕºŒ™
 £ª
£ª
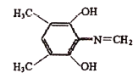
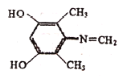
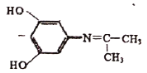
£®5£©BŒ™![]() £¨”ˆFeCl3»Ð“∫œ‘◊œ…´£¨Àµ√˜¥Ê‘⁄∑”Ù«ª˘£¨÷ª”–4÷÷≤ªÕ¨ªØ—ߪ∑æ≥µƒ«‚£¨Àµ√˜¥Ê‘⁄∂‘≥∆Ω·ππ£¨≤ª∫¨µ™—ıº¸°¢C=OÀµ√˜¥Ê‘⁄C=N£¨∑˚∫œÃıº˛µƒÕ¨∑÷“ÏππÃÂŒ™
£¨”ˆFeCl3»Ð“∫œ‘◊œ…´£¨Àµ√˜¥Ê‘⁄∑”Ù«ª˘£¨÷ª”–4÷÷≤ªÕ¨ªØ—ߪ∑æ≥µƒ«‚£¨Àµ√˜¥Ê‘⁄∂‘≥∆Ω·ππ£¨≤ª∫¨µ™—ıº¸°¢C=OÀµ√˜¥Ê‘⁄C=N£¨∑˚∫œÃıº˛µƒÕ¨∑÷“ÏππÃÂŒ™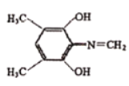 °¢
°¢ °¢
°¢ °¢
°¢ °£
°£



| ƒÍº∂ | ∏þ÷–øŒ≥à | ƒÍº∂ | ≥ı÷–øŒ≥à |
| ∏þ“ª | ∏þ“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı“ª | ≥ı“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ∂˛ | ∏þ∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı∂˛ | ≥ı∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ»˝ | ∏þ»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı»˝ | ≥ı»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° |
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø—–æø±Ì√˜£¨ƒ…√◊0º€Ω كл•≥˝µÿœ¬ÀÆ÷–µƒNO3-£¨≤ªÕ¨≥ı ºpH∫Õ≤ªÕ¨Ω Ù◊È≥…∂‘NO3-µƒ»•≥˝–ßπ˚»ÁÕºÀ˘ æ°£Õº1≥ı ºpH=5.5£¨Õº2≥ı ºpH=2£¨NO3-≥ı º≈®∂»æ˘Œ™50mg°§L-1£¨ƒ…√◊º∂Ω ÙÃ̺”¡øæ˘Œ™2g°§L-1°£œ¬¡–Àµ∑®’˝»∑µƒ «
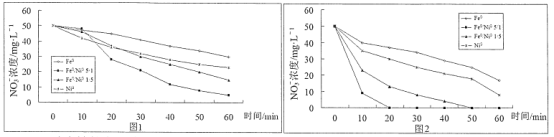
A.ƒ…√◊Ã˙µƒ»•≥˝–ßπ˚”≈”⁄ƒ…√◊ƒ¯
B.Õº2ƒ…√◊Ã˙∑¥”¶60mn ±NO3-»•≥˝¬ 67.2%£¨‘Ú60minƒ⁄![]()
C.µ±º”»ÎµƒΩ Ù «Fe0/Ni05/1£¨‘⁄≤ªÕ¨µƒ≥ı ºpHœ¬£¨æ≠π˝60min∫Û£¨NO3-µƒ»•≥˝¬ œýµ»
D.∆‰À˚Ãıº˛œýÕ¨ ±£¨»ÙpHπ˝µÕ£¨ø…ƒÐª·µº÷¬»•≥˝¬ œ¬Ωµ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø∏þ¥ø∂»æßÃÂπË «¡º∫√µƒ∞εºÃÂ≤ƒ¡œ£¨À¸µƒ∑¢œ÷∫Õ π”√“˝∆¡Àº∆À„ª˙µƒ“ª≥°°∞∏Ô√¸°±°£À¸ø…“‘∞¥œ¬¡–∑Ω∑®÷∆±∏£∫
SiO2![]() Si(¥÷)
Si(¥÷)![]() SiHCl3
SiHCl3![]() Si(¥ø)
Si(¥ø)
œ¬¡–Àµ∑®≤ª’˝»∑µƒ «£® £©
A.≤Ω÷Ë¢€÷–«‚∆¯◊˜ªπ‘≠º¡
B.πË∫Õ∂˛—ıªØπË∂ºƒÐ”√◊˜º∆À„ª˙°∞–æ∆¨°±
C.≤Ω÷Ë¢ŸµƒªØ—ß∑Ω≥Ã ΩŒ™£∫SiO2+2C![]() Si+2CO°¸
Si+2CO°¸
D.≤Ω÷Ë¢Ÿ¢⁄¢€÷–∑¢…˙µƒ∑¥”¶∂º Ù”⁄—ıªØªπ‘≠∑¥”¶
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øΩ´±Í◊º◊¥øˆœ¬µƒHCl∆¯ÃÂ4.48 L»Ð”⁄ÀÆ–Œ≥…100 mL»Ð“∫£¨»ª∫Û”Î◊„¡øµƒÃ˙–º≥‰∑÷∑¥”¶°£º∆À„£∫
£®1£©À˘µ√—ŒÀ·»Ð“∫µƒŒÔ÷ µƒ¡ø≈®∂»_______________
£®2£©≤Œº”∑¥”¶µƒÃ˙µƒ÷ ¡ø____________
£®3£©…˙≥…µƒH2µƒÃª˝(±Íøˆ)___________
£®4£©Ω´…˙≥…µƒFeCl2≈‰≥…400 mL»Ð“∫£¨¥À»Ð“∫÷–FeCl2µƒŒÔ÷ µƒ¡ø≈®∂»____________
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø¢Ò.µÁΩ‚∑®¥¶¿Ì∫¨µ™—ıªØŒÔ∑œ∆¯£¨ø…ªÿ ’œıÀ·°£ µ—È “ƒ£ƒ‚µÁΩ‚∑®Œ¸ ’NOxµƒ◊∞÷√»Á”“ÕºÀ˘ 森պ÷–µÁº´æ˘Œ™ ؃´µÁº´£©°£»Ù”√NO2∆¯ÃÂΩ¯––ƒ£ƒ‚µÁΩ‚∑®Œ¸ ’ µ—È°£
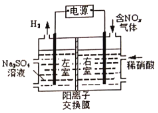
¢Ÿ–¥≥ˆµÁΩ‚ ±NO2∑¢…˙∑¥”¶µƒµÁº´∑¥”¶ Ω£∫________°£
¢⁄»Ù”–±Í◊º◊¥øˆœ¬2.24L NO2±ªŒ¸ ’£¨Õ®π˝—Ù¿Î◊”Ωªªªƒ§£®÷ª‘ –Ì—Ù¿Î◊”Õ®π˝£©µƒH+Œ™___mol°£
¢Ú.∆˚≥µŒ≤∆¯ «‘Ï≥…ŒÌˆ≤ÃÏ∆¯µƒ÷ÿ“™‘≠“Ú÷Æ“ª£¨“—÷™∆˚≥µŒ≤∆¯≈≈∑≈ ±»ð“◊∑¢…˙“‘œ¬∑¥”¶£∫¢Ÿ![]() °˜H1=+180kJ°§mol-1£¨¢⁄
°˜H1=+180kJ°§mol-1£¨¢⁄![]() °˜H2£¨¢€
°˜H2£¨¢€![]() °˜H3£¨“—÷™£∫CO∫ÕO2∑¥”¶œýπÿµƒªØ—ߺ¸º¸ƒÐº¸ƒÐ ˝æð»Áœ¬£∫
°˜H3£¨“—÷™£∫CO∫ÕO2∑¥”¶œýπÿµƒªØ—ߺ¸º¸ƒÐº¸ƒÐ ˝æð»Áœ¬£∫

£®1£©‘⁄∆˚≥µ…œ∞≤◊∞»˝‘™¥þªØ◊™ªØ∆˜ø… µœ÷∑¥”¶¢€£¨‘Ú∏√∑¥”¶‘⁄________£®ÃÓ∏þŒ¬°¢µÕŒ¬ªÚ»Œ∫ŒŒ¬∂»£©œ¬ƒÐ◊‘∑¢Ω¯––°£
£®2£©Œ™—–æøŒ¬∂»°¢¥þªØº¡∏∫‘ÿ¡ø∫Õ≤ªÕ¨¥þªØº¡∂‘NO»•≥˝¬ µƒ”∞œÏ°£Ω´NO∫ÕCO“‘“ª∂®µƒ¡˜ÀŸÕ®π˝≤ªÕ¨µƒ¥þªØº¡Ω¯––∑¥”¶æ≠π˝œýÕ¨ ±º‰ƒ⁄≤‚¡ø“ð≥ˆ∆¯ÃÂ÷–NOµƒ∫¨¡ø£¨¥”∂¯»∑∂®Œ≤∆¯Õ—µ™¬ £®Õ—µ™¬ º¥NOµƒ◊™ªØ¬ £©£¨Õº1 «≤ªÕ¨∏∫‘ÿ¡øµƒCu2+ µ—ÈΩ·π˚£¨Õº2 «≤ªÕ¨¥þªØº¡µƒ µ—ÈΩ·π˚£®¥þªØº¡¢Ÿ÷∏3%Co2+£¨¥þªØº¡¢⁄÷∏3%Cu2+£©°£
Õº1 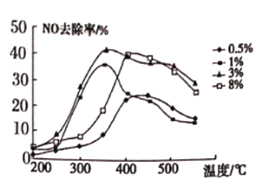 Õº2
Õº2 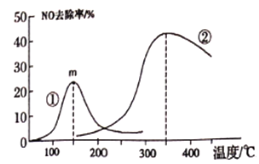
œ¬¡–Àµ∑®≤ª’˝»∑µƒ «________
A. Õº1Àµ√˜Cu2+∫¨¡ø‘Ω∏þÕ—µ™–ßπ˚‘Ω∫√
B. Õº1Àµ√˜Cu2+3%µƒ¥þªØº¡‘⁄350°Ê◊Û”“Õ—µ™–߬ ◊Ó∏þ
C. Õº2Àµ√˜µ⁄¢⁄÷÷¥þªØº¡±»µ⁄¢Ÿ÷÷¥þªØº¡Õ—µ™¬ ∏þ
D. Õº2Àµ√˜mµ„ «∆Ω∫‚µ„
£®3£©‘⁄ƒ≥Œ¬∂»œ¬£¨2L√б’»ð∆˜÷–≥‰»ÎNO°¢CO∏˜0.4molΩ¯––∑¥”¶¢€£¨≤‚µ√NOŒÔ÷ µƒ¡ø±‰ªØ»ÁÕºÀ˘ 棨5∑÷÷”ƒ©∑¥”¶¥ÔµΩ∆Ω∫‚£¨∏√∑¥”¶µƒ∆Ω∫‚≥£ ˝K=____°£µ⁄6∑÷÷”ºÃ–¯º”»Î0.2mol NO°¢0.2mol CO°¢0.2mol CO2∫Õ0.3mol N2£¨«Î‘⁄”“Õº÷–ª≠≥ˆµΩ9∑÷÷”ƒ©∑¥”¶¥ÔµΩ∆Ω∫‚NOµƒŒÔ÷ µƒ¡øÀÊ ±º‰µƒ±‰ªØ«˙œþ____°£
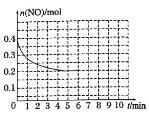
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øNA±Ì æ∞¢∑¸º”µ¬¬Þ≥£ ˝£¨œ¬¡–– ˆ÷–’˝»∑µƒ «
A. ±Í◊º◊¥øˆœ¬£¨22.4 LÀÆ÷–∫¨”–µƒÀÆ∑÷◊” ˝Œ™NA
B. 1 mol Fe”Î◊„¡øµƒ—ŒÀ·∑¥”¶µÁ◊”◊™“∆◊Ð ˝Œ™3NA
C. ≥£Œ¬≥£—πœ¬£¨22 g CO2÷–∫¨”–µƒ—ı‘≠◊” ˝Œ™NA
D. 500 mL 1 mol°§L-1MgCl2»Ð“∫÷–∫¨”–Cl©Å ˝ƒøŒ™0.5NA
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øΩÒƒÍ «√≈Ωð¡–∑Ú∑¢œ÷‘™Àÿ÷Ð∆⁄¬…150÷ЃͰ£œ¬±ÌŒ™‘™Àÿ÷Ð∆⁄±Ìµƒ“ª≤ø∑÷°£
ú | W | Y | |
X | ¡Ú | Z |
ªÿ¥œ¬¡–Œ £∫
£®1£©X‘™Àÿµƒ√˚≥∆ «______________°£
£®2£©Y‘™Àÿµƒ«‚ªØŒÔH2YµƒŒ»∂®–‘_____________£®ÃÓ°∞£æ°±ªÚ°∞£º°±£©H2S°£
£®3£©±Ì÷–‘™Àÿµƒ◊Ó∏þº€—ıªØŒÔ∂‘”¶µƒÀƪ،ÔÀ·–‘◊Ó«øµƒ «____________£®ÃÓªØ—ß Ω£©°£
£®4£©–¥≥ˆWµƒ◊Ó∏þº€∫¨—ıÀ·µƒœ°»Ð“∫”Î◊„¡øÃ˙∑€∑¥”¶µƒ¿Î◊”∑Ω≥à Ω_____________°£
£®5£©Ãº”Î√æø…–Œ≥…ªØ∫œŒÔM£¨»Ù1molM”ÎÀÆ∑¥”¶…˙≥…2 mol Mg(OH)2∫Õ1molÃ˛N£¨N∑÷◊”÷–ú«‚÷ ¡ø±»Œ™9:1£¨ M”ÎÀÆ∑¥”¶µƒªØ—ß∑Ω≥Ã ΩŒ™___________°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬¡–Àµ∑®’˝»∑µƒ «£® £©
A.”√∏ ∞±À·![]() ∫Õ±˚∞±À·
∫Õ±˚∞±À·![]() Àı∫œ◊Ó∂ýø…–Œ≥…3÷÷¡¥◊¥∂˛Îƒ
Àı∫œ◊Ó∂ýø…–Œ≥…3÷÷¡¥◊¥∂˛Îƒ
B.”√À·–‘![]() »Ð“∫ø…º¯±““»≤∫Õ““»©
»Ð“∫ø…º¯±““»≤∫Õ““»©
C.±˚œ©À·![]() ∫¨”–∂˛÷÷πŸƒÐÕ≈£¨÷ªƒÐ∑¢…˙»°¥˙∑¥”¶∫Õº”≥…∑¥”¶
∫¨”–∂˛÷÷πŸƒÐÕ≈£¨÷ªƒÐ∑¢…˙»°¥˙∑¥”¶∫Õº”≥…∑¥”¶
D.µ»÷ ¡øµƒº◊»©∫Õ»ÈÀ·![]() ÕÍ»´»º…’œ˚∫ƒµƒ—ı∆¯œýµ»£¨…˙≥…ÀƵƒ÷ ¡ø“≤œýµ»
ÕÍ»´»º…’œ˚∫ƒµƒ—ı∆¯œýµ»£¨…˙≥…ÀƵƒ÷ ¡ø“≤œýµ»
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø—«¬»À·ƒ∆(NaClO2) «“ª÷÷∏þ–ßµƒ∆Ø∞◊º¡∫Õ—ıªØº¡£¨ø…”√”⁄∏˜÷÷œÀŒ¨∫Õƒ≥–© ≥∆∑µƒ∆Ø∞◊°£¬ÌµŸ—∑(Mathieson)∑®÷∆±∏—«¬»À·ƒ∆µƒ¡˜≥ûÁœ¬£∫
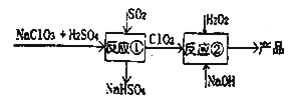
œ¬¡–Àµ∑®≤ª’˝»∑µƒ «( )
A.∑¥”¶¢ŸΩ◊∂Œ£¨≤Œº”∑¥”¶µƒNaClO3∫ÕSO2µƒŒÔ÷ µƒ¡ø÷Ʊ»Œ™21
B.∑¥”¶¢Ÿ—ıªØ≤˙ŒÔ”Ϊπ‘≠≤˙ŒÔµƒŒÔ÷ µƒ¡ø÷Ʊ»Œ™1£∫1
C.∑¥”¶¢⁄Ãıº˛œ¬£¨ClO2µƒ—ıªØ–‘¥Û”⁄H2O2∑¥”¶
D.¢⁄÷–µƒH2O2ø…”√NaClO4¥˙ÃÊ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
∞Ÿ∂»÷¬–≈ - ¡∑œ∞≤·¡–±Ì - ‘¡–±Ì
∫˛±± °ª•¡™Õ¯Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®∆Ωî | Õ¯…œ”–∫¶–≈œ¢æŸ±®◊®«¯ | µÁ–≈’©∆≠柱®◊®«¯ | …Ê¿˙ ∑–ÈŒÞ÷˜“”–∫¶–≈œ¢æŸ±®◊®«¯ | …Ê∆Û«÷»®æŸ±®◊®«¯
Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®µÁª∞£∫027-86699610 柱®” œ‰£∫58377363@163.com