
分析 (1)根据H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1可知,生成1molH2O放出热量为57.3kJ,然后根据水的物质的量与热量成正比求出热量;
(2)a燃烧热是指在25摄氏度,101 kPa时,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物的物质的量为1mol,产物必须是稳定氧化物据此解答;
b根据盖斯定律,结合③C(s)+$\frac{1}{2}$O2 (g)=CO(g);△H=-110.5kJ•mol-1;④C(s)+O2 (g)=CO2(g);△H=-393.5kJ•mol-1解答.
解答 解:(1)用20g即0.5molNaOH配成的稀溶液跟足量的稀盐酸反应,会生成0.5mol水,根据H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1可知,生成1molH2O放出热量为57.3kJ,所以此时放出的热量是$\frac{1}{2}$×57.3kJ=28.65kJ,故答案为:28.65;
(2)a根据燃烧热的定义,1mol氢气燃烧生成液态水更稳定,所以①H2(g)+$\frac{1}{2}$O2(g)=H2O(l);△H=-285kJ•mol-1;为氢气燃烧热的化学方程式,所以氢气的燃烧热为:-285kJ•mol-1;根据燃烧热的定义,1mol碳完全燃烧生成二氧化碳时放出的热量为碳的燃烧热,④C(s)+O2 (g)=CO2(g);△H=-393.5kJ•mol-1,为碳燃烧热的化学方程式,所以碳的燃烧热为:-393.5kJ•mol-1;
故答案为:-285kJ•mol-1;-393.5kJ•mol-1;
b根据盖斯定律,结合③C(s)+$\frac{1}{2}$O2 (g)=CO(g);△H=-110.5kJ•mol-1;④C(s)+O2 (g)=CO2(g);△H=-393.5kJ•mol-1,所以CO燃烧的热化学方程式为:④-③得:CO(g)+$\frac{1}{2}$O2 (g)=CO2(g);△H=-393.5kJ•mol-1+110.5kJ•mol-1=-283kJ•mol-1,故答案为:CO(g)+$\frac{1}{2}$O2 (g)=CO2(g);△H=-283kJ•mol-1.
点评 本题考查了燃烧热的定义和反应热的求算,题目难度不大,理解燃烧热概念时注意1物质的物质的量必须是1mol;2必须是完全燃烧生成稳定的氧化物.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:选择题
| A. | 长期使用(NH4)2SO4化肥会使土壤酸化,而过度使用尿素[CO(NH2)2]会使土壤碱化 | |
| B. | 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 | |
| C. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 | |
| D. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠固体保存在配有橡皮塞的细口瓶中 | |
| B. | 将SO2通入品红溶液或KMnO4溶液均能使它们褪色,均可证明有漂白性 | |
| C. | 不能在石英坩埚中熔化氢氧化钠 | |
| D. | 用湿润的pH试纸测定稀盐酸的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 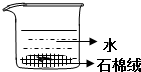 | B. | 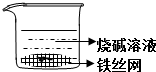 | ||
| C. | 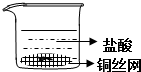 | D. | 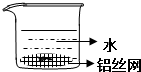 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| T/K | 2.98 | 398 | 498 |
| 平衡常数K | 2.44×10-6 | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
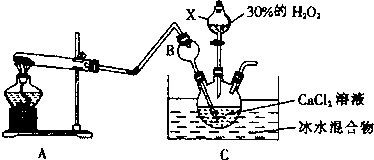
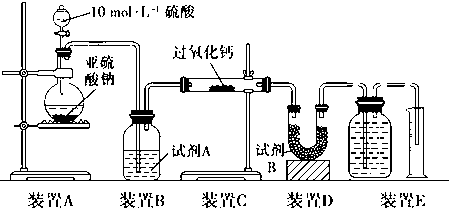
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②⑤ | C. | ②④ | D. | ③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com