
| A. | 在pH=0的溶液中:Na+、K+、MnO4-、I- | |
| B. | 中性溶液中:K+、SO42-、Fe3+、Na+ | |
| C. | c(H+)/c(OH-)=10-3的溶液中:Na+、K+、CO32-、S2- | |
| D. | 水电离出的H+为10-12溶液:K+、NH4+、Cl-、HCO3- |
分析 A.pH=0的溶液,显酸性,离子之间发生氧化还原反应;
B.Fe3+在pH为4.4左右沉淀完全;
C.c(H+)/c(OH-)=10-3的溶液,显碱性;
D.水电离出的H+为10-12溶液,为酸或碱溶液.
解答 解:A.pH=0的溶液,显酸性,H+、MnO4-、I-发生氧化还原反应,不能共存,故A不选;
B.Fe3+在pH为4.4左右沉淀完全,则中性溶液中不能大量存在Fe3+,故B不选;
C.c(H+)/c(OH-)=10-3的溶液,显碱性,该组离子之间不反应,可大量共存,故C选;
D.水电离出的H+为10-12溶液,为酸或碱溶液,酸碱溶液中均不能大量存在HCO3-,碱溶液中不能大量存在NH4+,故D不选;
故选C.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


科目:高中化学 来源: 题型:填空题
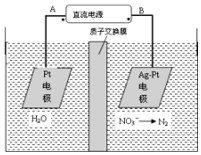 电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图,请写出阴极的电极反应式2NO3-+12H++10e-=N2↑+6H2O.
电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图,请写出阴极的电极反应式2NO3-+12H++10e-=N2↑+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
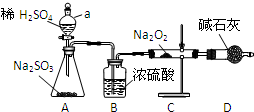

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
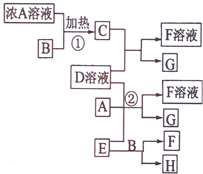 有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质,且受热易升华.实验室中,常用固体E在B的催化下加热制取气体单质H,H能使带火星的木条复燃.
有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质,且受热易升华.实验室中,常用固体E在B的催化下加热制取气体单质H,H能使带火星的木条复燃.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
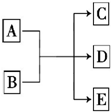 一定条件下,物质A~E转化关系如图所示,其中A为单质,常温下E为无色液体.
一定条件下,物质A~E转化关系如图所示,其中A为单质,常温下E为无色液体.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ•mol-1 | |
| B. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 059.3 kJ•mol-1 | |
| C. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-1 076.7 kJ•mol-1 | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 076.7 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com